盐酸倍他司汀氯化钠注射液质量分析论文
2024-06-03 12:01:49 来源: 作者:xuling
摘要:文章对44批次盐酸倍他司汀氯化钠注射液依据法定标准进行了检验,同时开展了有关物质、盐酸倍他司汀含量测定新方法的研究,并检验了渗透压摩尔浓度。按照法定标准检验,44批盐酸倍他司汀氯化钠注射液的合格率为100%,有关物质探索性研究检出杂质2-吡啶乙醇和2-乙烯基吡啶,且2-乙烯基吡啶含量较高。
摘要:文章对44批次盐酸倍他司汀氯化钠注射液依据法定标准进行了检验,同时开展了有关物质、盐酸倍他司汀含量测定新方法的研究,并检验了渗透压摩尔浓度。按照法定标准检验,44批盐酸倍他司汀氯化钠注射液的合格率为100%,有关物质探索性研究检出杂质2-吡啶乙醇和2-乙烯基吡啶,且2-乙烯基吡啶含量较高。结果表明,盐酸倍他司汀氯化钠注射液总体质量较好,生产工艺有待进一步提升,检验标准有待完善。
关键词:盐酸倍他司汀氯化钠注射液,质量分析,标准,探索性研究
Quality Analysis of Betahistine Hydrochloride and Sodium Chloride Injection
CHEN Yan,QI Yanchao,NIE Xiaohua
(Weifang Inspection and Testing Centre,Weifang 261000,China)
Abstract:In this paper,44 batches of betahistine hydrochloride and sodium chloride injection were tested according to the legal standards.At the same time,the related substances and the new method for the content of betahistine hydrochloride were studied,and the osmolality was detected.According to the legal standard,the qualified rate of 44 batches of betahistine hydrochloride sodium chloride injection was 100%.The impurities 2-pyridine ethanol and 2-vinyl pyridine were detected in the exploratory study of relevant substances,and the content of 2-vinyl pyridine was high.The results showed that the overall quality of betahistine hydrochloride sodium chloride injection is good,the production process needs to be further improved and the test standard needs to be improved.
Keywords:betahistine hydrochloride and sodium chloride Injection;quality analysis;legal standards;exploratory research
0引言
盐酸倍他司汀,化学名为N-甲基-2-吡啶乙胺二盐酸盐,为组胺类药物,对脑血管、心血管,特别是对锥底动脉系统有较强的扩张作用,能够显著增加心、脑及周围循环血流量,改善血循环,并降低全身血压,此外还能增加耳蜗和前庭血流量,从而消除耳内性眩晕、耳鸣和耳闭感。其主要用于治疗各种眩晕综合症、美尼尔综合症、高血压所致体位性眩晕、耳鸣及脑动脉硬化、缺血性脑血管疾病等[1-9]。
目前,国家药品监督管理局批准的盐酸倍他司汀的剂型有6种,分别为盐酸倍他司汀片、盐酸倍他司汀口服液、盐酸倍他司汀口服溶液、注射用盐酸倍他司汀、盐酸倍他司汀注射液、盐酸倍他司汀氯化钠注射液。其中,根据国家药品监督管理局网站数据库查询结果,全国共有40个盐酸倍他司汀氯化钠注射液生产厂家,涉及批准文号42个,产品规格有两种(分别为500 mL的盐酸倍他司汀0.02 g与氯化钠4.50 g和250 mL的盐酸倍他司汀0.02 g与氯化钠2.25 g)。
本研究在依据现行质量标准检验的基础上,针对检验过程中发现的问题及现行标准存在的不足,重点对有关物质、渗透压摩尔浓度和盐酸倍他司汀的含量进行了探索性研究,对当前盐酸倍他司汀氯化钠注射液的质量状况进行客观评价,为进一步提高产品质量及标准提供参考。
1仪器与试药
岛津LC-2030C型高效液相色谱仪,岛津UV2700型紫外可见分光光度计,梅特勒XSE205DU型电子分析天平,梅特勒S220K型酸度计,天大天发STY-1A型渗透压测定仪。
盐酸倍他司汀对照品(中国食品药品检定研究院,批号100265-201904,含量99.9%);2-吡啶乙醇对照品(上海阿拉丁生化科技股份有限公司,批号C2025125,含量98.0%),2-乙烯基吡啶对照品(上海阿拉丁生化科技股份有限公司,批号DM200427480,含量95.7%),乙腈为色谱纯,其他试剂均为市售分析纯。
本次抽检的44批盐酸倍他司汀氯化钠注射液规格均为500 mL(盐酸倍他司汀0.02 g与氯化钠4.5 g),共涉及生产厂家7个(其中A厂家25批,B厂家11批,C厂家3批,D厂家2批,E、F、G厂家各1批),占已获准生产企业的17.5%;批准文号7个,占全部文号的16.7%,在生产企业、经营企业、医疗机构抽取批次分别为20批、14批、10批,分别占该品种的45.5%、31.8%、22.7%。抽检样品确认率为100%。
2方法与结果
2.1法定标准检验
目前,盐酸倍他司汀氯化钠注射液的检验标准共有两个,分别为国家药品监督管理局国家药品标准WS-10001-(HD-0663)-2002及国家食品药品监督管理局标准YBH08212004。两个检验标准相比较,标准YBH08212004多一个有关物质检查项,其余检验项目和检验方法均相同。英国药典2021版、美国药典43版、日本药局方17版中均未收载。
鉴于注射液的剂型特点,本次风险监测抽取的44批盐酸倍他司汀氯化钠注射液主要进行了以下项目的检验:性状、紫外光谱扫描、pH值、可见异物、不溶性微粒、细菌内毒素、无菌、盐酸倍他司汀含量测定及氯化钠含量测定。另外,执行YBH08212004标准的样品同时进行了有关物质项的检验。结果按照各现行检验标准检验上述项目,44批次均符合规定,合格率为100%。下面主要对pH值、有关物质、含量测定结果做重点说明。
2.1.1 pH值
44批样品pH测定结果均分布在4.8~5.2之间,符合“pH值为4.0~6.0”的标准规定,不同厂家样品pH值比较接近。通过对抽样批次较多的A、B两厂家统计分析,各厂家批间差异较小,表现了良好的工艺控制条件。
2.1.2有关物质
对执行标准YBH08212004的样品按现行标准进行有关物质项检查,除溶剂峰外,均未检出杂质峰,符合“除溶剂峰外,其他杂质峰面积之和不得大于对照溶液的主峰面积(1%)”的标准规定。
2.1.3含量测定
盐酸倍他司汀含量采用紫外可见分光光度法测定,以吸收系数法计算。44批样品测定结果均符合标准规定,合格率为100%。44批样品盐酸倍他司汀含量均值为97.3%,最大值100.0%,最小值95.4%,极差4.6,主要集中在96.0%~98.0%之间,约占总批数81.8%。小于96.0%的共有4批次,均为A厂家产品。各厂家批次之间差异较小。
氯化钠含量采用容量分析法测定,44批样品测定结果均符合标准规定,合格率100%,其中在98.0%~100.0%之间的数量占比98.4%,44批次样品中氯化钠含量基本均匀,质量相对稳定。
2.2不同样品储藏条件对检验结果的影响
在全部抽验的44批次样品中,仓库期保存(保存条件为12℃,55%)的样品为41批次,合格样品为41批次,合格率为100%;货架期保存的样品3批次,合格样品为3批次,合格率为100%。结果表明,两种保存条件对检验结果无显著影响。
2.3有关物质探索性研究
2.3.1色谱条件
采用HPLC法,C18柱,紫外分光光度检测器;流动相:0.01 mol/L醋酸钠缓冲液(含0.005 mol/L庚烷磺酸钠、0.2%三乙胺,用冰醋酸调节pH值至3.5)-乙腈(95∶5),进样量:20μL;柱温:40℃;检测波长:261 nm,流速:1.0 mL/min,保留时间至盐酸倍他司汀保留时间的2.5倍。
2.3.2对照品储备液的制备
盐酸倍他司汀对照品储备液的制备:取盐酸倍他司汀对照品约10 mg,精密称定,置100 mL量瓶中,用流动相溶解并稀释至刻度,摇匀,作为对照品储备液。
杂质对照品储备液的制备:精密量取2-吡啶乙醇25 mg,置25 mL容量瓶中,加流动相使溶解并稀释至相应刻度,摇匀,即得2-吡啶乙醇对照品储备液;精密量取2-乙烯基吡啶对照品约20 mg,置10 mL容量瓶中,加流动相使溶解并稀释至相应刻度,摇匀,即得2-乙烯基吡啶对照品储备液。
2.3.3供试品溶液制备
取盐酸倍他司汀氯化钠注射液原液适量,用0.45μm微孔滤膜滤过,取续滤液作为供试品溶液。
2.3.4杂质对照品线性关系考察
取杂质对照品储备液,用流动相稀释配制成含2-吡啶乙醇对照品分别约为0.25、0.12、0.06、0.03、0.02、0.01μg/mL,含2-乙烯基吡啶对照品分别约为5.00、2.50、1.25、0.62、0.31、0.15μg/mL的混合杂质对照品溶液。照2.3.1节下色谱条件分别进样测定,记录峰面积。以各对照品浓度为横坐标、峰面积为纵坐标,计算得线性方程分别为y=151 298x+398.04(R2=0.999 3)、y=56 837x+509.5(R2=0.999 9)。结果表明,2-吡啶乙醇对照品浓度在0.01~0.25μg/mL范围内、2-乙烯基吡啶对照品浓度在0.15~5.00μg/mL范围内,均呈良好的线性关系。
2.3.5精密度试验
取含2-吡啶乙醇对照品0.03μg/mL、含2-乙烯基吡啶对照品约为0.62μg/mL的混合杂质对照品溶液,按照2.3.1节下色谱条件重复进样6次,测定峰面积,结果2-吡啶乙醇对照品峰面积RSD=0.40%,2-乙烯基吡啶对照品峰面积RSD=0.49%,表明仪器进样精密度良好。
2.3.6加样回收率试验
取2.3.5节下的混合杂质对照品3份,每份分别按溶液中各杂质含量的80%、100%、120%加入对照品储备液,加流动相稀释至刻度,摇匀,滤过。按2.3.1节下色谱条件进行测定,计算得2-吡啶乙醇平均回收率为98.86%,RSD=1.01%、2-乙烯基吡啶平均回收率为98.18%,RSD=0.84%。表明本法测定2-吡啶乙醇和2-乙烯基吡啶具有较好的加样回收率,说明该法准确可靠。
2.3.7检测限和定量限
取杂质对照品储备液适量,加流动相逐步稀释后测定,以信噪比S/N=3计算检测,2-吡啶乙醇的检测限为0.001 7μg/mL,2-乙烯基吡啶的检测限为0.010μg/mL。以信噪比S/N=10计算定量限,2-吡啶乙醇的定量限为0.005 8μg/mL,2-乙烯基吡啶的定量限为0.033μg/mL。
2.3.8空白辅料干扰实验
空白辅料溶液:按照处方比例称取空白辅料,溶于500 mL注射用无菌用水,摇匀即得。
对照品溶液:将盐酸倍他司汀对照品储备液精密量取10.00 mL至25 mL容量瓶,使用注射用无菌用水摇匀即得。
将空白辅料溶液,供试品溶液,对照品溶液,均照2.3.1项下色谱条件进样,记录色谱图,同时得到各主成分峰纯度因子。对照品与样品各主成分峰纯度均大于990,表明空白辅料对主成分的测定无干扰。
2.3.9样品测定
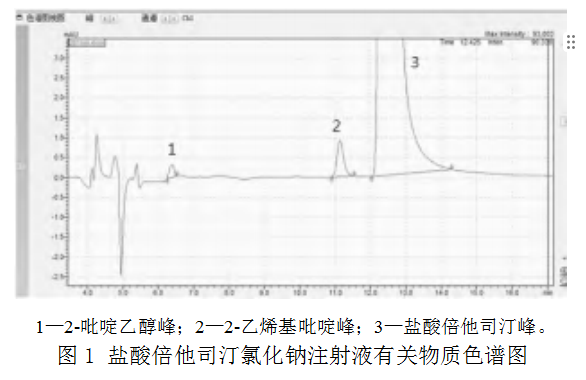
采用2.3.1节下色谱条件进行有关物质测定,44批样品均检出杂质2-吡啶乙醇和2-乙烯基吡啶,均未检出其他杂质。样品图谱见图1。按外标法以峰面积计算,含2-吡啶乙醇为盐酸倍他司汀标示量的0.04%~0.05%,各厂家各批次间差异较小;含2-乙烯基吡啶为盐酸倍他司汀标示量的0.50%~2.08%,各厂家之间、同厂家不同批次间差异均较大。对生产企业提供的盐酸倍他司汀原料进行检查,均未检出杂质。
2.3.10破坏实验
对供试品溶液进行酸破坏(1 mol/L盐酸溶液)、碱破坏(1 mol/L氢氧化钠溶液)、氧化破坏(30%过氧化氢溶液)、加热破坏(120℃)和光照破坏,在加热和氧化条件下,杂质2-吡啶乙醇峰面积均显著增大,在加热条件破坏下,杂质2-乙烯基吡啶峰面积显著增大。
2.3.11溶液稳定性
在室温条件下,分别于0、2、4、12、18、24 h取供试品溶液进样,记录色谱图峰面积,计算2-吡啶乙醇杂质峰面积RSD=0.96%,2-乙烯吡啶杂质峰面积RSD=1.10%。结果表明,供试品溶液在24 h内稳定。
2.4盐酸倍他司汀含量测定探索性研究
采用2.3.1节下色谱条件,取样品原液滤过后作为供试品溶液,精密称取盐酸倍他司汀对照品,以流动相为溶剂,制备相当浓度的溶液作为对照品溶液,测定44批次样品中盐酸倍他司汀含量。对比发现,使用该方法测得的结果与现执行标准中使用的紫外吸收系数法测得的含量结果基本一致。
2.5渗透压摩尔浓度探索性研究
采用冰点下降法测定样品的渗透压摩尔浓度。本次抽检的盐酸倍他司汀氯化钠注射液,渗透压摩尔浓度值在279~289 mOsmol/kg之间,渗透压摩尔浓度比为0.98~1.01。以0.9%的氯化钠为溶剂,以A厂家提供的盐酸倍他司汀原料制备系列浓度的盐酸倍他司汀溶液,分别测定渗透压摩尔浓度。结果显示,渗透压摩尔浓度值随着盐酸倍他司汀浓度的增大而增大,提示在盐酸倍他司汀氯化钠注射液中,盐酸倍他司汀和氯化钠共同影响样品渗透压摩尔浓度的大小。
3结论
3.1整体评价
本次抽验的44批次盐酸倍他司汀氯化钠注射液,按照现行标准检验合格率为100%,整体质量评价较好。通过对各厂家检验结果之间的比较发现,各厂家、各项结果之间的差异较小,说明制剂处方工艺和生产工艺总体控制较好;同一厂家不同批次样品检验结果差异较小,说明各厂家生产工艺较为稳定。但含量测定结果显示A厂家有4批次盐酸倍他司汀含量较低,有关物质探索性研究结果显示已知杂质含量普遍较高,提示本品投料比例和生产工艺有待进一步提升。
3.2有关物质
目前执行的标准WS-10001-(HD-0663)-2002无有关物质检查项,标准YBH08212004虽包含此项,但仅对各杂质峰面积和的限量做了规定,未对已知杂质进行控制,且采用此标准有关物质项下色谱条件检测,44批次均未检出有关物质。在探索性研究中,通过对国内外标准和相关文献中盐酸倍他司汀有关物质条件进行比对,考察了色谱柱、流动相种类、pH值、离子对试剂、检测波长、供试品溶液浓度以及记录时间等因素的影响,选择最优化条件对盐酸倍他司汀氯化钠注射液的有关物质进行了考察,并依据美国药典43版中给出的已知杂质[10],对检出的两个主要杂质进行定位。采用有关物质探索性研究色谱条件,44批次均检出杂质2-吡啶乙醇和2-乙烯基吡啶,且2-乙烯基吡啶含量较高。2-乙烯基吡啶具有急性毒性,杂质2-吡啶乙醇也有一定毒性,应严格控制含量。可见现行标准在盐酸倍他司汀氯化钠注射液有关物质的控制上还存在不足,建议增加或提高有关物质检验标准,规定已知杂质限度,以满足药品安全性的相关要求。
3.3含量测定
现行标准中,盐酸倍他司汀氯化钠注射液中盐酸倍他司汀含量测定采用吸收系数法,该方法受仪器状态及检测条件的影响较大、重现性较差,容易使准确度下降。采用有关物质探索性研究色谱条件检测,与标准方法测定结果基本一致;且取原液滤过后直接进样,可以减少取样误差和现行标准中稀释液(0.1 mol/L盐酸溶液)对样品可能带来的影响和干扰,简化了操作步骤,增加结果准确度。考虑HPLC方法较好的专属性和有效性以及有关物质和含量测定方法的一致性,建议采用HPLC法测定盐酸倍他司汀氯化钠注射液中盐酸倍他司汀含量。
3.4渗透压摩尔浓度
渗透压是注射液安全性的重要指标之一,中国药典(2020年版四部)附录中规定“在制备注射液、眼用液体制剂等药物制剂时,必须关注其渗透压。处方中添加了渗透调节剂的制剂,均应控制其渗透压摩尔浓度[11]”。现行的质量标准中均未对渗透压摩尔浓度进行测定和限定。研究发现,盐酸倍他司汀和氯化钠均可影响盐酸倍他司汀氯化钠注射液的渗透压摩尔浓度,建议标准中增加此项,控制产品质量,增加产品安全性。
3.5影响本品质量主要因素分析
盐酸倍他司汀原料中均未检测到有关物质,表明制剂中有关物质均由制剂生产和贮存过程中产生。破坏实验结果表明,盐酸倍他司汀在酸、碱、光照条件下稳定,在加热和氧化条件下易降解,其中杂质2-吡啶乙醇可在加热条件和氧化条件下降解产生,杂质2-乙烯基吡啶可在加热条件下降解产生,由此可以推测温度是影响本品质量的主要因素。根据本次抽验涉及生产企业提供的工艺资料,其生产工艺基本一致,其灭菌过程均采用115℃,灭菌30分钟。由于盐酸倍他司汀在加热条件下易降解,该灭菌过程极有可能增加了本品中有关物质的量。
本次抽验的盐酸倍他司汀氯化钠注射液,各企业所用的原辅料种类一致,均由盐酸倍他司汀、氯化钠、活性炭(供注射用)及注射用水组成。但活性炭用量差别较大,调研发现,处方中活性炭使用量最大的是A厂家,为45 g/500 L,最小的仅为4 g/500 L。活性炭能够去除注射剂中的热原,但同时对药物有一定的吸附作用。A厂家中有4批盐酸倍他司汀含量较低,是否与活性炭的使用量较多有关还需进一步探讨。根据注射剂一致性评价指导原则,注射剂不推荐使用活性炭。建议厂家改变处方工艺,减少活性炭对盐酸倍他司汀含量可能带来的影响。
参考文献:
[1]王丽萍.盐酸倍他司汀治疗眩晕症患者的临床效果及安全性评价[J].中国现代药物应用,2018,12(19):96-98.
[2]何素珍.盐酸倍他司汀联合手法复位治疗良性阵发性位置性眩晕的临床效果[J].临床合理用药,2021,14(8):64-65.
[3]杨远君.社区应用倍他司汀治疗椎基底动脉供血不足的临床观察[J].中国社区医师,2013(8):11.
[4]李楠楠.盐酸倍他司汀联合脉络宁治疗脑动脉供血不足性眩晕患者血流动力学及血清ILF-1、ET的影响[J].中国处方药,2021,19(10):106-108.
[5]笪云想.盐酸倍他司汀对眩晕症患者血液流变学影响及安全性分析[J].中国药物与临床,2021,21(14):2522-2523.
[6]田永超,张学敏,董莹.小剂量甘油果糖联合盐酸倍他司汀治疗老年急性眩晕的临床效果[J].中国老年学杂志,2021,41(21):4760-4762.
[7]白俊卿.丹参川芎嗪注射液联合盐酸倍他司汀治疗椎基底动脉系统供血不足疗效及对预后生存质量的影响[J].陕西中医,2018,39(3):301-303.
[8]陈清棠,赵玉宾.美克乐治疗眩晕症的开放性研究[J].中国新药杂志,1998,7(4):304-306.
[9]刘开福.盐酸倍他司汀氯化钠注射液治疗伴有1级高血压眩晕症58例[J].中外医学研究,2015,13(15):144-146.
[10]美国药典委员会.美国药典43版[M].华盛顿:美国药典委员会,2020:540.
[11]国家药典委员会.中华人民共和国药典(2020年版)四部[M].北京:中国医药科技出版社,2020:85.










