探讨恒温扩增法在下呼吸道感染病原体检测的价值论文
2024-05-18 10:44:02 来源: 作者:liyuan
摘要:探究运用恒温扩增法(Loop—mediated isothermal amplification,LAMP)在感染人群病原体诊断方面的价值。收集2022年1-8月255名下呼吸道感染患者的痰液或肺泡灌洗液(Bronchoalveolar lavage fluid,BALF),运用LAMP法和痰培养法同时对其进行检测,分析病原体检出情况、恒温扩增芯片法与痰培养法符合率。运用LAMP法检出阳性标本200例,总阳性率为78.43%,共检出呼吸道病原体10种;运用痰培养法检测出阳性标本80例,总阳性率为31.37
摘要:探究运用恒温扩增法(Loop—mediated isothermal amplification,LAMP)在感染人群病原体诊断方面的价值。收集2022年1-8月255名下呼吸道感染患者的痰液或肺泡灌洗液(Bronchoalveolar lavage fluid,BALF),运用LAMP法和痰培养法同时对其进行检测,分析病原体检出情况、恒温扩增芯片法与痰培养法符合率。运用LAMP法检出阳性标本200例,总阳性率为78.43%,共检出呼吸道病原体10种;运用痰培养法检测出阳性标本80例,总阳性率为31.37%,共检出呼吸道病原体8种。两种方法检出的铜绿假单胞菌的阳性率具有高度一致性(Kappa=0.516),鲍曼不动杆菌、肺炎克雷伯菌的阳性率具有中等一致性(0.4<Kappa<0.6)。恒温扩增法的病原体检出率显著高于传统痰培养法;相较于金标准痰培养法,其对苛养菌的检测具有较好的一致性。但LAMP法检测时间更短、总阳性率更高,更有助于临床医生快速精准地识别所感染的病原体。
关键词:下呼吸道感染;恒温扩增法;痰培养;病原体
呼吸道感染分为上呼吸道感染和下呼吸道感染。下呼吸道感染多为细菌、病毒、真菌、非典型病原体、结核杆菌复合群等病菌感染[1],与下呼吸道感染相关的重要病原体包括肺炎支原体、肺炎链球菌以及其他常见病原体,如流感嗜血杆菌、肺炎克雷伯菌、肺炎衣原体和金黄色葡萄球菌[2]。肺炎链球菌和流感嗜血杆菌都是营养需求极高的苛养菌[3],其标本采集与接种时间不应超过30 min,因此其培养阳性率很低。肺炎支原体只能通过检测IgM抗体来判断,IgM抗体通常可以在病原体感染一周左右被检测到[4],这对早期诊断和早期临床指导药物的选择造成了限制。WHO 2020年的最新统计数据显示,发达国家下呼吸道感染的死亡率居于第六[5]。分析LAMP技术在下呼吸道感染病原体诊断方面的表现,以期提高病原菌诊断的精准性,为医生选择抗菌药物提供更准确的指导。
1材料与方法
1.1一般资料
本研究选择2022年1-8月在我院接受治疗的255例下呼吸道感染患者开展研究。其中男性177例(69.4%),女性78例(30.6%)。患者年龄为4-83岁,平均年龄62.25岁。纳入标准:①以2016年版《中国成人社区获得性肺炎诊断和治疗指南》[6]和2019年版《儿童社区获得性肺炎诊疗规范》为标准[7],确定对患者的诊断是否符合标准;②接受同时进行LAMP法及痰培养法病原学检测;③入院前未使用免疫抑制剂。排除标准:①不满足2016年版《中国成人社区获得性肺炎诊断和治疗指南》和2019年版《儿童社区获得性肺炎诊疗规范》要求的患者;②有其他基础疾病,长期使用激素及其他免疫抑制剂的患者;③不能配合进行样本采集者。
1.2研究方法
痰培养法:在巧克力色血琼脂平板、血琼脂平板和麦康凯琼脂平板上分别接种适量痰样本或BALF,将其放入5%~10%的二氧化碳培养箱,于35℃培养24 h或48 h,观察培养结果,筛选出可能的致病菌。
恒温扩增法:采用微流控芯片、热稳定聚合酶以及先进的恒温扩增技术,将反应置于65℃的稳定环境中,以实现链置换效果。通过使用荧光染料,对阳性样品进行荧光检测。通过核酸分析仪对样品进行分析,该分析仪可同时检测13种下呼吸道感染的常见病原体。
1.3仪器与试剂
核酸检测试剂和RTisochipTM-A热稳定扩增芯片分析仪,由博奥生物集团有限公司生产;II级B2型生物安全柜,由苏洁医疗器械(苏州)有限公司生产;干式恒温加热器,由杭州奥盛仪器有限公司生产;病原体培养鉴定所用的血琼脂平板、巧克力色血琼脂平板、麦康凯琼脂平板,由郑州安图生物工程股份有限公司生产;细菌鉴定仪,由珠海迪尔生物工程股份有限公司生产;二氧化碳培养箱,由日本三洋公司生产。
1.4统计学处理
用SPSS 24.0统计软件对数据进行分析处理。两组间的临床资料比较用百分比和例数表示,用X2检验。若X2检验的显著性小于0.05,则说明存在显著性差异。计算Kappa值以评估其一致性。
2结果
2.1两种检测方法的检测结果
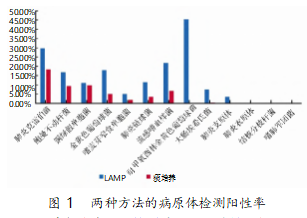
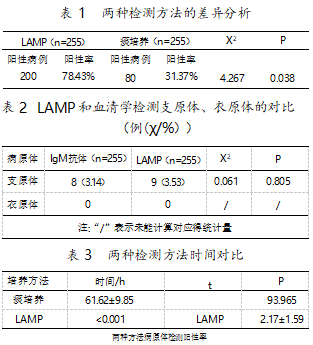
在255份痰样本中,LAMP法在200例样本中检出了呼吸道病原体,总阳性率为78.43%;痰培养法在80例样本中检测到了呼吸道病原体,总阳性率为31.37%。LAMP法的总阳性率明显高于痰培养法(P<0.05),表明二者的差异具有统计学意义(表1)。LAMP法鉴定出的主要病原体为耐甲氧西林的金黄色葡萄球菌,其次是流感嗜血杆菌与肺炎克雷伯菌。痰培养法检测到的主要病原体为肺炎克雷伯菌,其次是鲍曼不动杆菌与铜绿假单胞菌(图1)。肺炎支原体检测出了8例IgM阳性,阳性率3.14%,肺炎衣原体未检出;LAMP法检测出肺炎支原体9例,阳性率3.53%,同样未检出肺炎衣原体,两种方法对肺炎支原体的检测无统计学差异(P<0.05)(表2)。但通过对比检测时间,发现LAMP法较血清学和痰培养法检测时间更短(表3)。
2.2两种方法病原体检测结果的一致性分析
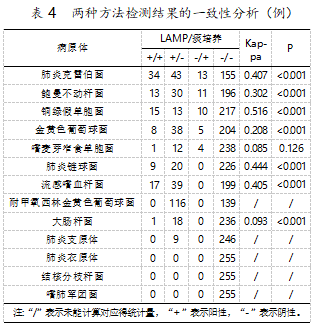
分析LAMP法和痰培养法对病原体检测结果的一致性(表4)。结果显示,二者对于铜绿假单胞菌的检测具有高度一致性(Kappa=0.516),对于肺炎克雷伯菌、鲍曼不动杆菌的检测具有中等一致性(0.4≤kappa<0.6),对于金黄色葡萄球菌、嗜麦芽窄食单肥功、肺炎链球菌和流感嗜血样菌检测的一致性良好(0.2≤kappa<0.4)。虽然对大肠埃希氏菌检测的一致性较差,但LAMP法比痰培养法的检出阳性率高,差异具有统计学意义(P<0.05)。除嗜麦芽窄食单胞菌,两种方法对其他病原体的检测结果的差异均具有统计学意义(P<0.001)。
3讨论
下呼吸道感染是临床较为常见的一种多发性疾病,对人类生命健康造成了严重的威胁。研究表明,下呼吸道感染的成年人死亡率约为3%~5%[8],若治疗不及时可发展为重症,重症死亡率达30%~50%[9-10]。根据File等[11]的研究,北美平均每年在治疗社区获得性肺炎方面的支出高达170亿美元。肺炎链球菌、流感嗜血杆菌、结核分支杆菌复合群等属于苛养菌[12],营养要求高,一般从送检到接种的时间不能超过30 min[13]。嗜肺军团菌是一种细胞内寄生细菌[14],传统细菌培养法所需的培养鉴定周期长、操作繁琐,进行细菌培养可能会延误对疾病的诊断[15]。LAMP法可以在很短的时间内(约2 h)完成对多种呼吸道病原体的检测,可同时检测出12种病原体和1种耐甲氧西林葡萄球菌耐药基因(mecA基因)[16]。
在本次研究中,LAMP法检测出了200份阳性标本,总阳性率达78.43%;而传统培养法检出的阳性率仅为31.37%。通过对我院下呼吸道病原体分布的统计分析,发现在200份阳性标本中,金黄色葡萄球菌、肺炎克雷伯菌和流感嗜血杆菌的检出率最高。
本研究利用LAMP法对下呼吸道感染患者的标本进行检测,通过对13种病原体的检测,我们发现,肺炎克雷伯杆菌是造成下呼吸道感染的主要原因,其次为耐甲氧西林的金黄色葡萄球菌及鲍曼不动杆菌。经过分析,本次研究结果与我院当年呼吸道标本分离细菌的分布情况基本一致,但与当年全国细菌耐药监测网发布的数据存在一定的出入,这可能是由地域差异导致的。采集和运输方式不当会对培养阳性率产生较大影响[17]。
本文的主要局限在于样本量较小且仅来自单个医院,仅包括255名患者,研究结果可能无法代表更大的人群或适用于不同的医疗环境。未来的研究应采用更大的样本量、多中心设计、综合纳入标准并与金标准测试比较,以克服上述局限性并提供可靠和适用性更强的研究结果。另外在细菌培养过程中,还发现了雷式普罗威登菌、烟曲霉、屎肠球菌、产气克雷伯菌、曲霉菌5种病原体,尽管LAMP十三项联检可以检测出13种常见病原体,但它仍存在局限性,仍无法完全覆盖全部病原体。通过细菌培养,我们可以确定菌株是否耐药,但LAMP十三联检只能鉴定菌种,无法确定耐药基因[18]。
总而言之,与常规痰培养法相比,恒温扩增检测法可以在短时间内检测出引发感染的病原体,检测时间短,阳性率高,有助于医生在短时间内精准判断引发下呼吸道感染的病原微生物,从而有针对性地使用抗生素进行治疗。
参考文献
[1]EDIN A,EILERS H,ALLARD A.Evaluation of the Biofire Filmarray Pneumonia panel plus for lower respiratory tract infections[J].Infectious Diseases,2020,52(7):479-88.
[2]GADSBY N,MCHUGH M,RUSSELL C,et al.Development of two real-time multiplex PCR assays for the detection and quantification of eight key bacterial pathogens in lower respiratory tract infections[J].Elsevier Sponsored Documents,2015,21(8):788.e1-788.e13.
[3]IKKEN Y,R魪DA C,ELOUENNASS M,et al.The novel biphasic medium for transport,culture and conservation at an ambient temperature of Neisseria meningitidis,Streptococcus pneumoniae and Haemophilus influenzae[J].World Journal of Microbiology and Biotechnology,2021,37(11):1-10.
[4]TSAI T-A,TSAI C-K,KUO K-C,et al.Rational stepwise approach for Mycoplasma pneumoniae pneumonia in children[J].Journal of Microbiology,Immunology and Infection,2021,54(4):557-565.
[5]徐晓娜,孙昕,王莉莉,等.LAMP法和传统培养法检测下呼吸道感染常见病原体的比较研究[J].安徽医学,2021,42(7):802-805.
[6]张迪,钱晓君,褚水莲,等.2002—2016年中国呼吸系统疾病死亡率及其变化趋势[J].中华医学杂志,2020,100(24):1895-1900.
[7]MUSCEDERE G J,ANDREW D,HEYLAND K D.Mortality,attributable mortality,and clinical events as end points for clinical trials of ventilator-associated pneumonia and hospital-acquired pneumonia.[J].Clinical Infectious Disease,2010(Supplement1):S120-S125.
[8]CHARLES F,ERICA S.Epidemiology of lower respiratory tract infections in adults.[J].Expert review of respiratory medicine,2019,13(1):63-77.
[9]MICEK T S,CHEW B,HAMPTON N,et al.A Case-Control Study Assessing the Impact of Nonventilated Hospital-Acquired Pneumonia on Patient Outcomes[J].Chest,2016,150(5):1008-1014.
[10]RESTREPO M I,MORTENSEN E M,RELLO J,et al.Late Admission to the ICU in Patients With Community-Acquired Pneumonia Is Associated With Higher Mortality[J].Chest,2010,137(3):552-557.
[11]JR F M T,MARRIE J T.Burden of Community-Acquired Pneumonia in North American Adults[J].Postgraduate Medicine,2015,122(2):130-141.
[12]T W,A T,D N.Clinical and economic burden of community-acquired pneumonia among adults in Europe[J].Thorax,2012,67(1):71-79.
[13]STUDAHL M,LINDQUIST L,Eriksson B M,et al.Acute viral infections of the central nervous system in immunocompetent adults:diagnosis and management[J].Drugs,2013,73(2):131-158.
[14]侯莉莉,刘莉丽,党萍,等.河北省三甲医院2013至2016年呼吸道感染致病菌变化特点分析:附单中心7?497例病例报告[J].中华危重病急救医学,2017,29(9):799-804.
[15]IKKEN Y,R魪DA C,ELOUENNASS M,et al.The novel biphasic medium for transport,culture and conservation at an ambient temperature of Neisseria meningitidis,Streptococcus pneumoniae and Haemophilus influenzae[J].World Journal of Microbiology Biotechnology,2021,37(11):187.
[16]李艳燕,高美丽,赛亚飞,等.呼吸道病原体核酸恒温扩增芯片十三联检在下呼吸道感染诊断中的价值[J].中华肺部疾病杂志(电子版),2019,12(2):171-174.
[17]田磊,张真,陈中举,等.某院流感嗜血杆菌耐药性及其对氨苄西林耐药机制[J].中国感染控制杂志,2015,14(2):73-76.
[18]CHEN Y,LIU T,LANGFORD P,et al.Haemophilus parasuis induces activation of NF-κB and MAP kinase signaling pathways mediated by toll-like receptors[J].Molecular Immunology,2015,65(2):360-366.










