乳酸菌第二信使分子c-di-AMP 研究进展论文
2024-05-17 09:32:53 来源: 作者:liyuan
摘要:微生物依赖信号识别和信号传递来感知并响应外界环境变化。c-di-AMP作为第二信使分子在信号传导过程中发挥着关键作用,其通过酶、转录调控因子和核糖开关等受体靶标来调控细胞生长、生物膜形成、K+稳态、DNA完整性、细胞壁合成和脂肪酸合成等与生理功能相关的基因和蛋白的表达。尽管对于c-di-AMP代谢调控在枯草芽孢杆菌、单增李斯特氏菌和金黄色葡萄球菌等细菌中的研究较为深入,但对其在乳酸菌中的研究却相对较少。基于此,文章重点关注乳酸菌中c-di-AMP的代谢及其在K+稳态和抑制甘氨酸甜菜碱转运中的信号传导作用;
摘要:微生物依赖信号识别和信号传递来感知并响应外界环境变化。c-di-AMP作为第二信使分子在信号传导过程中发挥着关键作用,其通过酶、转录调控因子和核糖开关等受体靶标来调控细胞生长、生物膜形成、K+稳态、DNA完整性、细胞壁合成和脂肪酸合成等与生理功能相关的基因和蛋白的表达。尽管对于c-di-AMP代谢调控在枯草芽孢杆菌、单增李斯特氏菌和金黄色葡萄球菌等细菌中的研究较为深入,但对其在乳酸菌中的研究却相对较少。基于此,文章重点关注乳酸菌中c-di-AMP的代谢及其在K+稳态和抑制甘氨酸甜菜碱转运中的信号传导作用;同时,通过总结现有研究中的乳酸菌c-di-AMP代谢调控,深化对乳酸菌第二信使分子信号调控的认知。
关键词:乳酸菌;第二信使分子;环二腺苷酸
微生物响应外界环境变化和调控生理代谢主要依赖与信号识别和传递机制。其中,第二信使分子(Secondary messenger molecule)在信号传导调控过程中发挥着关键作用。典型的第二信使分子包括环磷酸腺苷(cAMP)、四磷酸鸟苷(ppGpp)、环二鸟苷酸(c-di-GMP)以及最近发现的环二腺苷酸(c-di-AMP)。其在生物膜形成、碳代谢和细胞壁稳态等多种生理过程中发挥着关键作用[1-6]。2008年首次在海栖热袍菌DNA完整性扫描蛋白(DNA integrity scanning protein A,DisA)的晶体结构中发现了c-di-AMP,随后开展的一系列相关研究表明,c-di-AMP广泛参与到革兰氏阳性菌、革兰氏阴性菌和古细菌保持DNA完整性、K+稳态、脂肪酸合成和细胞壁稳态等过程中,具有多种生理功能[7-10]。
乳酸菌是一类利用可发酵碳水化合物产生大量乳酸的细菌的统称,广泛存在于牛奶、蔬菜、肉类、豆类和谷物基质等食品及相关制成品中。同时,乳酸菌也广泛分布于人类和哺乳动物的口腔、胃肠道和泌尿生殖道等环境中。乳酸菌在生长和生存过程中不可避免地会受到高酸、高渗等各种环境的刺激,需要通过信使分子感知并调控胞内相关基因转录水平和/或转录后水平的变化来适应外界环境的变化。目前研究尚未发现乳酸菌可以合成c-di-GMP和cAMP等环状核苷酸,但发现其可以合成c-di-AMP。鉴于乳酸菌在食品中的重要应用,本文重点关注近期乳酸菌中c-di-AMP信号系统相关研究的进展,特别是分析综述乳酸菌中c-di-AMP代谢以及c-di-AMP浓度变化时生理功能的变化。
1乳酸菌中第二信使分子c-di-AMP代谢途径
1.1 c-di-AMP的合成
细胞内的c-di-AMP水平会受到参与其合成、降解以及外排泵作用的影响。二腺苷酸环化酶(DAC)以ATP或ADP为底物,合成c-di-AMP。已鉴定的四种主要类型DAC为DisA[11]、CdaA[12](也称为DacA或YbbP)、CdaS[13](也称为YojJ)和CdaM[14],且其蛋白活性与DAC结构域/DisA_N结构域密切相关(见图1)。与大多数厚壁菌门细菌一样,乳酸菌主要编码的DAC为CdaA,用于催化ATP合成c-di-AMP[15-16]。CdaA由3个N端跨膜结构域(TMD)和一个C端细胞质DAC结构域组成,其活性位点具有Asp-Gly-Ala(DGA)和Arg-His-Arg(RHR)基序[12]。结构分析表明,CdaA二聚体需要形成寡聚复合物才能具有催化活性。由此可见,阻断寡聚体形成是抑制c-di-AMP合成的一种有效策略[15]。
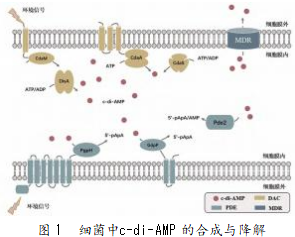
基因CdaR位于操纵子CdaAR-GlmM,用于编码一种功能未知的蛋白质,含有一个TMD和位于细胞膜外侧的3个或4个YbbR结构域(IPR012505),并通过TMD直接与CdaA相互作用[17]。在一些链球菌菌株中,CdaA与CdaR蛋白融合,且这些融合蛋白的AlphaFold结构预测表明CdaA的第一个TMD可能是与CdaR、TMD相互作用的结构域。CdaR的功能目前不明确,但研究发现,其在调节CdaA合成c-di-AMP方面具有一定的作用。基因GlmM位于基因cdaR的下游,用于编码一种重要的葡萄糖胺磷酸变位酶,负责葡萄糖胺-6-磷酸和葡萄糖胺-1-磷酸的相互转化,可以参与细胞壁肽聚糖和其他细胞壁聚合物的合成。在乳酸乳球菌中,GlmM直接与CdaA结合并抑制c-di-AMP的合成活性[18]。GlmM的这种抑制活性在厚壁菌门中广泛存在,结构分析表明,GlmM的结合可以防止形成具有催化活性的CdaA寡聚物[19]。乳酸乳球菌GlmM单个氨基酸突变(I154F)可增强与CdaA的结合,并进一步导致c-di-AMP以及肽聚糖前体UDP-N-乙酰氨基葡萄糖的胞内含量降低,表明c-di-AMP或CdaA可能会参与细胞壁合成的过程[18]。
1.2 c-di-AMP的分解
尽管c-di-AMP对细菌生长和代谢至关重要,但其过度积累可能会损害细胞的功能。磷酸二酯酶(PDE)能够感知浓度升高的c-di-AMP,并将其分解为线性磷酸腺苷5'-pApA或AMP(见图1)。当前已经发现的PDE蛋白主要有GdpP、PgpH和Pde2,通常包含DHH/DHHA1和HD活性结构域以及高度保守的活性位点Asp-His-His[20-23]。乳酸菌中最常见的PDE是GdpP和DhhP(Pde2同源物)。其中,GdpP除了DHH/DHHA1结构域之外,还包括2个TMD、PAS结构域和退化的GGDEF结构域;而DhhP仅含有DHH/DHHA1结构域。GdpP通过TMD结构域锚定在细胞膜上。其中,肺炎链球菌中,GdpP的空间结构对其催化活性至关重要,然而关于其在乳酸菌中的作用机制还缺乏相应的研究。GdpP是一种具有高度选择性的环状二核苷酸水解酶,仅对c-di-AMP具有高亲和力;而DhhP并不具有底物特异性,可将c-di-AMP或5'-pApA裂解为AMP。粪肠球菌GdpP和DhhP单基因失活突变体中c-di-AMP的含量分别是野生型的3~5倍;而GdpP和DhhP双基因失活突变体中c-di-AMP的含量是野生型的8倍[24-25]。
PDE酶活性可通过多种调节剂改变胞内c-di-AMP水平来响应细胞内外的刺激。信号分子ppGpp能够强力地抑制金黄色葡萄球菌GdpP和单增李斯特氏菌PgpH引起的c-di-AMP水解[1]。此外,GdpP的信号传感结构域PAS结构域可结合血红素来感知其他蛋白中的氧化还原电位、光、金属离子和氧等信号。粪肠球菌中截短的GdpP(仅含DHH/DHHA1结构域)分解活性是完整GdpP的13倍,表明TMD、PAS和GGDEF结构域可以在抑制c-di-AMP分解方面发挥作用[26]。化脓链球菌中GdpP的TMD对细胞功能有着至关重要的影响,仍需进一步研究乳酸菌GdpP的PAS和退化的GGDEF结构域以及PgpH细胞外结构域在感知环境信号和调节PDE活性方面的作用。
1.3 c-di-AMP的外排
除PDE酶促降解外,c-di-AMP还可通过细胞的主动外排降低胞内浓度。在单增李斯特氏菌多重耐药泵分泌的生物活性配体鉴定实验中,通过LC-MS/MS对MdrM多重耐药泵(Lmo1617)过表达菌株的培养物上清液进行分析,发现MdrM具有外排c-di-AMP的能力。乳酸乳球菌中Llmg_1210为EmrB家族有多重耐药泵,与单增李斯特氏菌MdrM氨基酸序列的同源性达到36%。基因Llmg_1210与基因rmaX(编码转录调节因子)和Llmg_1211(编码功能未知的膜蛋白)共同组成一个操纵子。通过强启动子在△GdpP突变株中分别过表达rmaX、Llmg_1210和Llmg_1211,发现rmaX或Llmg_1211单基因过表达不会降低细胞内的c-di-AMP浓度,但Llmg_1210和Llmg_1211的共表达会导致胞内c-di-AMP含量显著降低,而胞外c-di-AMP浓度显著升高[27]。单增李斯特氏菌中c-di-AMP外排会导致细胞肽聚糖合成减少,进而导致细胞对靶向细胞壁生物合成的抗生素的敏感性增加,但c-di-AMP外排引起的乳酸菌表型变化以及胞外c-di-AMP浓度升高是否会引起宿主的免疫反应还需进行更加深入的研究。
2 c-di-AMP的受体蛋白
细菌在感受到外部环境的刺激时,c-di-AMP通过下游分子与其受体蛋白的相互作用变化来发挥其在信号转导中的作用。因此,鉴定细菌c-di-AMP靶点及其结构和功能对于揭示c-di-AMP信号转导机制至关重要。已鉴定的c-di-AMP受体主要包括酶、RNA和转录调节因子[28-31]。最先鉴定的c-di-AMP受体蛋白是耻垢分枝杆菌DarR转录调控因子。在此过程中,c-di-AMP通过增强DarR的DNA结合能力来抑制靶基因的转录表达,使细胞形态和脂肪酸合成等表型发生显著变化[32]。随后在单增李斯特氏菌、金黄色葡萄球菌和枯草芽孢杆菌等厚壁菌门中鉴定出了KtrCD、KimA和CpaA等多种与K+稳态相关的受体蛋白[33-37]。然而,目前在乳酸菌中仅发现了与K+转运相关的KupA和KupB蛋白,以及转录调控因子BusR可以特异性结合的c-di-AMP,且在鉴定结合过程中并未发现新的保守结构域。
3乳酸菌中第二信使分子c-di-AMP的调控作用
3.1 c-di-AMP在乳酸菌K+摄取中的作用
K+是所有生物体细胞中含量最多的一种单价阳离子,对于调节渗透压、膜电位、酸碱平衡、基因表达和细胞质酶活性等生物学功能至关重要。迄今为止,细菌已进化出五种K+转运蛋白(Kdp系统、KimA蛋白、Ktr系统、Trk系统和Kup系统),用于使细胞内的K+浓度达到稳态,以满足pH稳态、质子动力产生、细胞膨胀和蛋白质合成等过程中对K+的需求。其中,Kup蛋白广泛存在于乳杆菌、肠球菌,以及少数链球菌和葡萄球菌中,也是所有乳酸乳球菌中唯一已知的保守K+转运蛋白。乳酸乳球菌基因组通常含有KupA-KupB操纵子,但MG1362菌株仅能通过KupB吸收K+来满足细胞对膨胀、质子动力和pH稳态的需求。△GdpP突变体在高渗条件下无法存活,但△GdpP菌株过表达导致突变的KupBA618V蛋白(K+吸收增强)可以使其恢复在高渗条件下的生长[27]。此时,菌株胞内c-di-AMP与K+浓度均显著提高,但RT-qPCR结果显示CdaA的表达水平无显著变化。由此可知,K+浓度升高与c-di-AMP含量增加的相关性还需进行更深入的探讨。乳酸乳球菌IL1403通过c-di-AMP特异性结合KupA和KupB,抑制其K+转运活性,使细胞K+摄取减少[38]。
3.2 c-di-AMP在乳酸菌甘氨酸甜菜碱转运中的作用
乳酸菌为响应渗透胁迫会输入或合成甘氨酸甜菜碱、肉碱、脯氨酸、海藻糖和四氢嘧啶等相容性溶质[39]。其中,乳酸菌含有甘氨酸甜菜碱高亲和力的ABC转运系统BusA(OpuA),由BusAA和BusAB蛋白组成。其中,BusAB由底物结合结构域(SBD)与TMD融合形成;而BusAA是胞内ATP结合蛋白[40]。BusR是BusAB操纵子的转录调节因子,通过结合操纵子启动子直接抑制BusAB的表达。RT-qPCR结果显示,在非盐胁迫条件下乳酸乳球菌MG1363的△GdpP突变株BusAA的表达量比野生型对照菌株低5倍。培养基中盐浓度提高至0.5 M时,GdpP突变株BusAA表达量显著提高,由此猜测BusA与c-di-AMP之间存在关联[27,41]。厌氧条件下,无乳链球菌△GdpP突变体无法在含800 mM NaCl的培养基上生长,而△GdpP菌株BusR突变后可以恢复生长。测定配体的径向差异毛细管作用实验DRaCALA确定了c-di-AMP与BusR的相互作用。无乳链球菌△GdpP突变体会导致c-di-AMP浓度升高,而高浓度c-di-AMP结合BusR可强烈抑制BusAB的表达,导致甘氨酸甜菜碱的摄取减弱,使菌株在高渗环境中敏感性增强[41]。
4总结与展望
第二信使分子发挥其调控功能的第一步是感知外界环境变化。虽然相关研究显示,c-di-AMP合成酶的TMD或其相互作用蛋白CdaR的YbbR结构域可能会参与信号接收[12,16],但仍需通过深入研究阐明c-di-AMP的信号输入过程。识别环境信号后,c-di-AMP可通过多种受体靶标调控细菌的DNA完整性、K+稳态和生物膜形成等多种生理功能。受体靶标(酶、转录调控因子和核糖开关)的鉴定对于解析c-di-AMP的调控机制至关重要。然而,目前乳酸菌中仅鉴定出与渗透胁迫相关的KupA、KupB和BusR3种受体蛋白[27,38],极大地限制了对乳酸菌c-di-AMP调控机制的解析。乳酸乳球菌GdpP与KupB双突变体中,K+与c-di-AMP的浓度均显著提高。然而,这种提高与c-di-AMP合成酶和分解酶的作用无关,因此猜测存在其他蛋白与K+运输相关,并同时与c-di-AMP也存在关联[27]。c-di-AMP通过结合单增李斯特氏菌和金黄色葡萄球菌OpuC及乳酸乳球菌BusR的CBS结构域[28],对受体蛋白活性进行调节。然而,生物信息学分析表明,在其他乳酸菌(如嗜热链球菌)中OpuABC转运系统不含CBS结构域。这是否表明其他乳酸菌存在新的调节机制或新的受体靶标?后续可通过2’-AHC-c-diAMP-Agarose或c-di-AMP偶联磁珠亲和层析广泛鉴定乳酸菌中存在的各种新的c-di-AMP受体靶标,并通过Crispr基因编辑方法构建相应的突变菌株,同时结合RNA-seq等组学手段确定其生物学功能,以阐明乳酸菌c-di-AMP的信号传导调控机制。
参考文献
[1]PETERSON B N,YOUNG M K M,LUO S,et al.(p)ppGpp and c-di-AMP homeostasis Is controlled by CbpB in Listeria monocytogenes[J].Microbiology,2020,11(4):e01625-20.
[2]LIANG Z X.The expanding roles of c-di-GMP in the biosynthesis of exopolysaccharides and secondary metabolites[J].The Royal Society of Chemistry,2015,32(5):663-683.
[3]TAZIN FAHMI S F,GARY C PORT,KYU HONG CHO.The second messenger c-di-AMP regulates diverse cellular pathways involved in stress response,biofilm formation,cell wall homeostasis,SpeB expression,and virulence in Streptococcus pyogenes[J].Infection and Immunity,2019,87(6):e00147-19
[4]金华,马春骥,韩杨,等.c-di-AMP——细菌中第二信使的研究进展[J].微生物学杂志,2019,39(6):109-116.
[5]全旭,王鹤龄,张慧彦,等.c-di-GMP及其对细菌生物膜调控作用的研究进展[J].现代口腔医学杂志,2018,32(6):352-356.
[6]彭显,李继遥,徐欣.c-di-AMP调控细菌生物被膜的形成[J].生物工程学报,2019,33(9):1369-1375.
[7]HAMPTON H G,JACKSON S A,FAGERLUND R D,et al.AbiEi Binds Cooperatively to the Type IV abiE Toxin-Antitoxin Operator Via a Positively-Charged Surface and Causes DNA Bending and Negative Autoregulation[J].J Mol Biol,2018,430(8):1141-1156.
[8]PENG X,ZHANG Y,BAI G,et al.Cyclic di-AMP mediates biofilm formation[J].Molecular Microbiology,2016,99(5):945-959.
[9]BAI Y,YANG J,ZARRELLA T M,et al.Cyclic di-AMP impairs potassium uptake mediated by a cyclic di-AMP binding protein in Streptococcus pneumoniae[J].Journal of Bacteriology,2014,196(3):614-623.
[10]CHENG X,ZHENG X,ZHOU X,et al.Regulation of oxidative response and extracellular polysaccharide synthesis by a diadenylate cyclase in Streptococcus mutans[J].Environmental Microbiology,2016,18(3):904-922.
[11]GREGOR WITTE S H,KATHARINA BUTTNER,KARL-PETER HOPFNER.Structural biochemistry of a bacterial checkpoint protein reveals diadenylate cyclase activity regulated by DNA recombination intermediates[J].Molecular Cell,2008,30(2):167-78.
[12]HEIDEMANN J L,NEUMANN P,DICKMANNS A,et al.Crystal structures of the c-di-AMP-synthesizing enzyme CdaA[J].Journal of Biological Chemistry,2019,294(27):10463-70.
[13]ZHENG C,MA Y,WANG X,et al.Functional analysis of the sporulation-specific diadenylate cyclase CdaS in Bacillus thuringiensis[J].Frontiers in Microbiology,2015,6:908-927.
[14]BLOTZC,TREFFON K,KAEVER V,et al.Identification of the components involved in cyclic di-AMP signaling in Mycoplasma pneumoniae[J].Frontiers in Microbiology 2017,8:1328-38.
[15]ROSENBERG J,DICKMANNS A,NEUMANN P,et al.Structural and biochemical analysis of the essential diadenylate cyclase CdaA from Listeria monocytogenes[J].Journal of Biological Chemistry,2015,290(10):6596-606.
[16]GUNDLACH J,MEHNE F M,HERZBERG C,et al.An Essential Poison:Synthesis and Degradation of Cyclic Di-AMP in Bacillus subtilis[J].Journal of Bacteriology,2015,197(20):3265-74.
[17]FAHMI T,PORT G C,CHO K H.C-di-AMP:an essential molecule in the signaling pathways that regulate the viability and virulence of gram-positive bacteria[J].Genes 2017,8(8):197-214.
[18]ZHU Y,PHAM T H,NHIEP T H,et al.Cyclic-di-AMP synthesis by the diadenylate cyclase CdaA is modulated by the peptidoglycan biosynthesis enzyme GlmM in Lactococcus lactis[J].Molecular Microbiology,2016,99(6):1015-27.
[19]TOSI T,HOSHIGA F,MILLERSHIP C,et al.Inhibition of the Staphylococcus aureus c-di-AMP cyclase DacA by direct interaction with the phosphoglucosamine mutase GlmM[J].PLOS Pathogens,2019,15(1):e1007537.
[20]RAO F,SEE R Y,ZHANG D,et al.YybT is a signaling protein that contains a cyclic dinucleotide phosphodiesterase domain and a GGDEF domain with ATPase activity[J].Journal of Biological Chemistry,2010,285(1):473-82.
[21]BAI Y,YANG J,EISELE L E,et al.Two DHH subfamily 1 proteins in Streptococcus pneumoniae possess cyclic di-AMP phosphodiesterase activity and affect bacterial growth and virulence[J].Journal of Bacteriology,2013,195(22):5123-32.
[22]WANG F,HE Q,SU K,et al.Structural and biochemical characterization of the catalytic domains of GdpP reveals a unified hydrolysis mechanism for the DHH/DHHA1 phosphodiesterase[J].Biochemical Journal 2018,475(1):191-205.
[23]HUYNH T N,LUO S,PENSINGER D,et al.An HD-domain phosphodiesterase mediates cooperative hydrolysis of c-di-AMP to affect bacterial growth and virulence[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(7):e747-56.
[24]RøRVIK G H,LISKIEWICZ K A,KRYUCHKOV F,et al.Cyclic Di-adenosine Monophosphate Regulates Metabolism and Growth in the Oral Commensal Streptococcus mitis[J].Microorganisms,2020,8(9):1269-81.
[25]KUNDRA S,LAM L N,KAJFASZ J K,et al.c-di-AMP Is Essential for the Virulence of Enterococcus faecalis[J].Infection and Immunity,2021,89(11):e0036521.
[26]WANG X,DAVLIEVA M,REYES J,et al.A novel phosphodiesterase of the GdpP family modulates cyclic di-AMP levels in response to cell Membrane stress in daptomycin-resistant enterococci[J].Antimicrobial Agents and Chemotherapy,2017,61(3):e01422-16.
[27]PHAM H T,NHIEP N T H,VU T N M,et al.Enhanced uptake of potassium or glycine betaine or export of cyclic-di-AMP restores osmoresistance in a high cyclic-di-AMP Lactococcus lactis mutant[J].PLOS Genetics,2018,14(8):e1007574.
[28]COMMICHAU F M,GIBHARDT J,HALBEDEL S,et al.A delicate connection:c-di-AMP affects cell integrity by controlling osmolyte transport[J].Trends in Microbiology,2018,26(3):175-85.
[29]REN A,PATEL D J.c-di-AMP binds the ydaO riboswitch in two pseudo-symmetry-related pockets[J].Nature Chemical Biology,2014,10(9):780-6.
[30]GAO A,SERGANOV A.Structural insights into recognition of c-di-AMP by the ydaO riboswitch[J].Nature Chemical Biology,2014,10(9):787-92.
[31]NELSON J W,SUDARSAN N,FURUKAWA K,et al.Riboswitches in eubacteria sense the second messenger c-di-AMP[J].Nature Chemical Biology,2013,9(12):834-9.
[32]ZHANG L,LI W,HE Z G.DarR,a TetR-like transcriptional factor,is a cyclic di-AMP-responsive repressor in Mycobacterium smegmatis[J].Journal of Biological Chemistry,2013,288(5):3085-96.
[33]DUTTA A,BATISH M,PARASHAR V.Structural basis of KdpD histidine kinase binding to the second messenger c-di-AMP[J].Journal of Biological Chemistry,2021,296:100771-88.
[34]CHOI P H,SUREKA K,WOODWARD JJ,et al.Molecular basis for the recognition of cyclic-di-AMP by PstA,a PII-like signal transduction protein[J].Microbiologyopen,2015,4(3):361-74.
[35]KRUGER L,HERZBERG C,WICKE D,et al.Sustained control of pyruvate carboxylase by the essential second messenger cyclic di-AMP in bacillus subtilis[J].Microbiology,2021,13(1):e0360221.
[36]CORRIGAN R M,CAMPEOTTO I,JEGANATHAN T,et al.Systematic identification of conserved bacterial c-di-AMPreceptor proteins[J].Proceedings of the National Academy of Sciences of the United States of America,2013,110(22):9084-9.
[37]KIM H,YOUN S J,KIM S O,et al.Structural studies of
potassium transport protein KtrA regulator of conductance of K+(RCK)C domain in complex with cyclic diadenosine monophosphate(c-di-AMP)[J].Journal of Biological Chemistry,2015,290(26):16393-402.
[38]QUINTANA I M,GIBHARDT J,TURDIEV A,et al.The KupA and KupB proteins of lactococcus lactis IL1403 are novel c-di-AMP receptor proteins responsible for potassium uptake[J].Journal of Bacteriology,2019,201(10):e00028-19.
[39]高薇,韩雪,张兰威.乳酸菌渗透胁迫相关相容性溶质及其转运机制研究进展[J].微生物学通报,2013,40(11):2097-106.
[40]OBIS D G A,GRIPON JC,RENAULT P,BOLOTIN A,MISTOU MY.Genetic and biochemical characterization ofa high-affinity betaine uptake system(BusA)in Lactococcus lactis reveals a new functional organization within bacterial ABC transporters[J].Journal of Bacteriology,1999,181(20):6238-46.
[41]DEVAUX L,SLEIMAN D,MAZZUOLI M V,et al.Cyclic di-AMP regulation of osmotic homeostasis is essential in Group B Streptococcus[J].PLOS Genetics,2018,14(4):e1007342.










