产志贺毒素大肠埃希氏菌活菌检测方法的应用现状及展望论文
2024-05-13 10:44:01 来源: 作者:liyuan
摘要:产志贺毒素大肠埃希氏菌作为一种重要的食源性致病菌,会对人体健康造成严重威胁。对其进行快速、准确的鉴定检测是预防和控制相关疾病的有效手段。基于此,文章对目前可用于检测活体产志贺毒素大肠埃希氏菌的方法进行综述,主要包括传统的细胞培养方法、免疫学检测方法和分子生物学方法等,并对这些方法的应用和发展前景展开了深入探讨。随着分子生物学和生物工程技术的发展,不同检测方法联合使用可以克服单一方法的缺陷,从而取得更高效、准确的检测结果。
摘要:产志贺毒素大肠埃希氏菌作为一种重要的食源性致病菌,会对人体健康造成严重威胁。对其进行快速、准确的鉴定检测是预防和控制相关疾病的有效手段。基于此,文章对目前可用于检测活体产志贺毒素大肠埃希氏菌的方法进行综述,主要包括传统的细胞培养方法、免疫学检测方法和分子生物学方法等,并对这些方法的应用和发展前景展开了深入探讨。随着分子生物学和生物工程技术的发展,不同检测方法联合使用可以克服单一方法的缺陷,从而取得更高效、准确的检测结果。
关键词:产志贺毒素大肠埃希氏菌;活体;检测方法
产志贺毒素大肠埃希氏菌(Shiga toxin-producing Escherichia coli,STEC)是一类可产生志贺毒素1(Shiga toxin 1,Stx1)或志贺毒素2(Shiga toxin 2,Stx2)的大肠埃希氏菌的总称,是重要的食源性致病菌。其感染引发的临床症状较多,主要有腹泻、出血性结肠炎(hemorrhagic colitis,HC)以及溶血性尿毒综合征(hemolytic uremic syndrome,HUS)等[1]。目前,已发现的STEC血清型共有400余种,其中超过200种血清型与人类疾病有关[2]。STEC中除了O157:H7之外的血清型菌株统称为非O157 STEC,主要有O26、O45、O103、O111、O121和O145六大类。2011年,德国由STEC O104:H4污染豆芽引发的食源性疾病暴发事件,引起了全世界对非O157 STEC的广泛关注[3]。
针对STEC的检测,传统检测方法一般包括前增菌、选择性增菌、分离纯化,以及最后的生化鉴定。但是该方法步骤复杂、耗时耗力,无法满足快速检测鉴定的要求,且容易出现假阴性结果,对一些表型变异的菌株很难用形态学加以辨别。故而我国在2016年发行了新的致泻大肠埃希氏菌检验标准《GB/T4789.6-2016》[4],与先前的标准相比,现行方法增加了血清学试验中H抗原的鉴定,以及聚合酶链式反应技术(polymerase chain reaction,PCR)确认试验。美国农业部同食品安全与检验局(USDA/FSIS)曾发布了生牛肉产品中STEC O157的零容忍政策,将6种非O157血清型致病菌纳入其中,并将实时PCR检测方法纳入检测方案[5],同时国际标准化组织(ISO)也采用了一种基于实时PCR检测5种主要STEC的方法[6]。由此可见,分子生物学检测手段已被广泛应用于多个国家及其组织机构中。为克服细胞培养方法的局限性,众多学者提出了许多更快速高效的非细胞培养方法,以检测区分食源性致病菌中的死菌或活菌。本文重点介绍了传统培养法、免疫学法和分子生物学方法等检测方法,并讨论了其在活体STEC检测方面的应用情况及缺陷,以期为进一步探究STEC的代谢状态,以及研发效率、灵敏度和准确性更高的检测方法提供参考。
1传统细胞培养法
传统细胞培养方法灵敏度较高、成本较低且操作简单,便于广泛使用,已成为食源性致病菌检测的“金标准”。因此,该方法仍是目前许多食品检测机构的首选。传统的STEC检测步骤通常包含前增菌、选择性增菌、分离纯化,以及最后的生化鉴定。然而,整个检测时间较长,不能满足市场对快速准确的测定结果的需求。
由于样品中STEC的污染浓度较低,且其本身含有大量微生物,会对检测结果造成重大影响,所以为了提高检测方法的灵敏度和准确度,增菌培养基的选择是必要且关键的一步[7]。Guerini等[8]比较了12种用于STEC O157:H7检测的增菌培养基,并发现了胰蛋白大豆肉汤(Modified Tryptic Soy Broth,TSB)在相同的培养条件下,其增菌效果与其他增菌培养基相比无明显差异,且操作更简单、费用最低,因此该类培养基可以得到广泛应用。另一方面,由于食品基质中STEC污染浓度较低,因此在增菌培养时通常会添加一些抗生素来抑制非目标菌生长,使STEC成为增菌肉汤中的优势菌,从而实现指数式增长。例如,将采集的样品在添加新生霉素[9]或其他抗生素的改良胰蛋白大豆肉汤(Modified Tryptic Soy Broth,mTSB)中富集培养,可抑制其他杂菌生长,同时使STEC快速增长,以提高分离率。作为对比,有研究发现,使用添加新生霉素的TSB(mTSB)直接培养受损的STEC O157比使用缓冲蛋白胨液(Buffered Peptone Water,BPW)或先用BPW修复培养再用mTSB培养的方法灵敏度更高[10]。然而,此方法使用mTSB增菌培养基虽然能够达到较好的STEC O157增菌效果,但STEC的血清型众多,使用添加抗生素的增菌培养基能否更广泛地适用于非O157 STEC仍是研究的重点。因此,Gill等[11]针对非O157 STEC菌株,设计了多种不同的增菌培养方案。其选取了包括新生霉素在内的6种抗生素作为添加剂,通过单独或联合使用的形式探究了培养基对多种不同血清型STEC的增菌效果。结果发现,与单独使用相比,新生霉素与其他抗生素联合使用时,其对所有STEC菌株都有明显的生长抑制作用。同样,抗生素的联合使用也可以抑制其他非目标菌的生长,且未体现出良好的选择性。目前,我国食品安全监测报告中大多都采用GB4789.6[4]检测方法,选用营养肉汤、肠道菌增菌肉汤等非选择性增菌培养基,而国际现行检测STEC标准方法中推荐在增菌培养基中使用吖啶黄、头孢磺啶和新生霉素等抑菌抗生素[5-6]。基于此,国内研究正在积极开展针对STEC标准方法的相关探索。胡颖等[12]利用携带不同亚型志贺毒素基因的STEC菌株、非产志贺毒素大肠埃希氏菌及非大肠埃希氏菌等不同菌株,测定了几种国际检测STEC标准方法在增菌培养基中使用的最低抑菌浓度,以探究抗生素及其使用浓度对不同亚型STEC生长及其检测的影响机制。结果发现,STEC在不同培养基中对同一种抗生素具有不同的最低抑菌浓度,其中新生霉素在2种不同浓度的培养基中对多种STEC亚型菌株存在漏检的情况。此外,各标准方法推荐使用的吖啶黄、头孢磺啶和新生霉素等抑菌抗生素对某些STEC亚型菌株具有抑制作用;且其中,仅对革兰氏阳性菌具有良好的抑制性,而对其他革兰氏阴性菌的抑制效果不佳。
值得一提的是,大肠埃希氏菌具有较好的耐酸性,为STEC检测中的增菌培养环节提供了新思路。有研究者(见表1)通过改变增菌培养条件,既保持了菌体的活性状态,又有效抑制了背景杂菌的生长,获得了更高的STEC生长量,提高了检测效率。李琼琼等[17]选择12株不同血清型STEC菌株及13株常见背景干扰菌进行了对比研究,以评价其对不同酸处理条件(pH=2.0、2.5、3.0)的耐受性,并比较增菌前与增菌后2种酸处理方式对STEC菌株分离效果的影响。结果发现,所有STEC菌株在pH=2.0的培养基中酸处理4 h后均能存活。与此同时,部分背景菌也表现出了较强的耐酸性,但在pH=2.0的培养基中室温处理2 h后便丧失了存活能力。因此,可选择pH为2.0,室温处理2 h作为STEC菌株酸处理的有效筛选条件。在将该条件应用于人工污染牛肉馅样品中STEC的检测后发现,增菌前进行酸处理可以有效降低背景菌对STEC检测的干扰,同时低pH处理不会明显影响胁迫状态STEC菌株的生长。
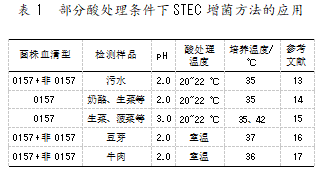
此外,分离培养基的选择会影响到STEC检测结果的准确性,是分离纯化这一环节的关键。常用的分离培养基有山梨醇麦康凯琼脂(Sorbitol MaConkey agar,SMAC)、Rainbow agar、CHRO Magar等,且这些选择性琼脂最早用于检测STEC O157:H7[18]。March S B等[19]根据O157:H7不发酵山梨醇,而大部分非O157 STEC发酵山梨醇的特点设计了SMAC,并将其成功应用于STEC检测。Pao等[20]发现在使用SMAC检测粪便中的STEC时,只有当接种水平达到105 CFU/g及以上,才能将其成功分离,且同时在使用改良后的SMAC时,接种浓度也要保持在103 CFU/g及以上。另外,STEC O157:H7可在CHROM agar琼脂平板上形成粉红色菌落,其内含的特殊显色底物可保证高敏感性和特异性,并可避免目前由于部分产毒菌株生化性变异而造成的漏检现象;结果显示,其分离检测效果优于SMAC。根据这一特点,李晓红[21]发现,利用肠出血性大肠埃希氏菌琼脂平板可快速、准确地从食品中分离并检测STEC。另一方面,非O157 STEC的分离培养方法也逐渐成熟,如使用含有亚碲酸钾和头孢克圬的CT-SMAC。范如岳等[22]检测了476株非O157 STEC分离株的亚碲酸钾抗性水平,并对其在多种选择性培养基上的生长情况进行了评价。结果发现,非O157 STEC菌株在不同培养基上的菌落特征多样性明显,且大多数菌株对亚碲酸钾具有较高的敏感度;同时,牛粪便样品的分离效果显示,将不含亚碲酸钾的MAC与含有一定浓度亚碲酸钾的选择性培养基Rainbow agar结合使用,可有效提高复杂菌群环境中非O157 STEC的分离率。
2免疫学检测方法
免疫学方法的原理是结合抗原靶点与抗体可用表位的特异性。其在食品检测中的应用方法有酶联免疫吸附(Enzyme linked immunosorbent assay,ELISA)、免疫层析(Immunochromatographic assay,ICA)和免疫磁分离法(Immuno-magnetic separation,IMS)等。
2.1酶联免疫吸附法
酶联免疫吸附的原理是把酶标记到抗体(或抗原)上,并把相应抗体(或抗原)固定在固相载体上,二者混合可使抗原抗体特异性结合形成复合物。随后,加入相应底物,发生酶促反应从而产生有色物质,导致颜色变化识别待测物质,以进行定量或定性检测。与细胞培养法相比,酶联免疫吸附法更高效、特异性更强[23]。遇晓杰等[24]使用STEC O157酶联免疫试剂盒检测了生鸡肉中的STEC O157:H7,检测限达1 CFU/25 g。其研究发现,相较于传统培养法,酶联免疫节省了平板培养时间且准确性、特异性更高。同样,Zhao等[25]构建了一种新型ELISA方法以快速检测牛肉中的STEC O157:H7,该方法的检测时间不超过3 h,且可以对人工污染牛肉样品进行定量检测,检测限可达1 CFU/25 g。
2.2免疫层析法
免疫层析的原理是将抗体固定在硝化棉膜的特定区域上,并将硝化棉膜的一段浸入样品溶液中,通过毛细作用,使样品向另一端移动,当移动到有抗体的区域时,抗体就会与相应抗原发生特异性结合,颜色发生变化,进而进行定量或定性检测。陈明慧[26]研究了一种STEC O157:H7双金新型免疫层析试纸条。结果发现,猪肉样品上的背景杂菌会造成假阳性结果,而使用改进的MAC增菌培养基可以有效避免该现象的发生;同时,用胶体金试纸条检测猪肉样品,检测限可达2 CFU/g。此外,无需复杂抗体标记的免疫层析方法实现了快速检测。王宗汉[27]将功能化普鲁士蓝纳米材料作为免标记探针,并将其应用于牛奶等基质中STEC O157:H7的检测,检测限可达到102 CFU/mL。
2.3免疫磁分离法
免疫磁分离法[28]是指将具有高度特异性的抗体(或抗原)偶联在磁性小球表面,在其中加入一定量的待检样品,组成目标菌—抗体(或抗原)—磁珠复合体,并在外部施加磁场,使复合体与其他基质分离,从而达到富集分离效果。该方法操作简单、耗时较短,常与其他检测手段协同使用,可有效扩大检测范围,提高检测灵敏度。Huang等[29]制备了一种结合荧光磁性纳米粒子的免疫层析方法,对牛奶中STEC O157:H7进行了定量检测,检测限达2.39×102 CFU/mL。同样,文湘郡等[30]建立了免疫磁珠结合荧光量子点标记抗体检测STEC O157:H7的方法。该方法使用的纳米磁珠提高了对目标菌的选择效率,对人工污染牛肉样品的检测限高达10 CFU/mL。
3分子生物学检测方法
目前,分子生物学检测方法在我国已得到了广泛的应用。以核酸为基础的方法可以通过检测特定的DNA或RNA序列来鉴定STEC。根据不同的核酸扩增和检测方法,可将其分为PCR检测技术和等温扩增技术。
3.1聚合酶链式反应技术
聚合酶链式反应技术(Polymerase chain reaction,PCR)是目前可用于食源性致病菌检测的最有效的一种生物技术,根据不同的核酸扩增和检测方法,可将其分为荧光定量PCR(Quantitative polymerase chain reaction,qPCR)、多重PCR(Multiplex PCR,mPCR)、数字PCR(Digital PCR,dPCR)等。
3.1.1荧光定量PCR技术
荧光定量聚合酶链式反应技术基于常规PCR技术,在扩增反应体系中加入特异性引物的同时,再加入一个特异性荧光探针,以使用实时监测的荧光PCR检测仪来检测靶基因(如stx1、stx2和eae等基因)。其优点是灵敏度更高、特异性更强,可快速筛选STEC的靶基因,进行全封闭反应,且无需进行PCR产物后处理,可有效避免污染。魏婉晴等[31]建立了一种实时荧光定量PCR快速检测试剂盒。通过研究发现,在4种常见食源性致病菌的干扰下,荧光定量PCR仍能准确检测出STEC O157:H7;同时,可降低检测限,可低至84 CFU/mL。基于O157型STEC和非O157型STEC的特异基因,Singh等[32]设计了低成本的qPCR方法,用于准确检测7种血清型STEC和沙门氏菌。此检测方法不依赖荧光探针或免疫磁珠,适用于牛肉中致病菌的常规检测。
3.1.2多重PCR技术
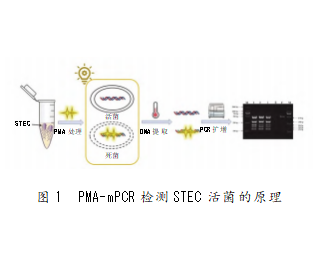
多重PCR是在同一反应体系中加入两对及以上的引物,并同时扩增出多个核酸片段的PCR反应。一方面,细菌死后其DNA仍然存在,传统的mPCR技术并不能区分活细胞和死细胞。而活性插入染料如叠氮溴化丙锭(propidium monoazide,PMA)可选择性穿透膜受损的死亡细胞,并在光活化时与DNA交联,使其在PCR过程中无法扩增,从而消除死亡细胞DNA的干扰(见图1)。Xie等[33]将PMA对活菌的选择性与mPCR相结合,建立了一种可同时检测包括STEC O157:H7在内的4种致病菌的检测方法。结果发现,经过6~8 h的培养富集,该方法对STEC O157:H7的检测限可达到7 CFU/mL。另一方面,STEC的血清型及基因亚型种类较多,特异性引物和探针设计、扩增条件设定等将成为影响mPCR检测方法灵敏度及准确性的关键。Li等[34]针对stx1和stx2基因建立了一种可同时检测STEC O157:H7和非O157 STEC的mPCR方法。该方法通过优化扩增条件,减少了扩增过程中探针间的干扰和引物间的供应竞争,有效避免了假阴性结果的产生,并且可成功应用于人工污染STEC样品的检测。此外,stx1和stx2基因还包括众多亚型[35],为开发可用于检测所有stx亚型的引物带来了巨大的挑战。Hu等[36]对各检测机构标准化方法中使用的筛选引物和探针组的特异性进行了研究。研究结果显示,四种标准化方法的引物和探针均对stx1a、stx1c、stx2a和stx2c亚型的灵敏度较高,而对stx2f的检测灵敏度较低。另外,这四种方法对其他亚型的灵敏度均存在差异,其中ISO方法能够检测除stx2f以外的所有stx2和stx2亚型。因此,研究者利用ISO方法开发了基于pan-stx2筛选引物的筛查系统,并将该方法在国内7个省级实验室中进行了验证。在100 CFU/g的接种水平下,各实验室均可在碎牛肉和豆芽样品中检出多种stx2亚型菌株,更证明了此方法的可行性。
3.1.3数字PCR
数字PCR将一个PCR反应分隔成多个子反应,并将每个子反应分区视为一个单独的PCR微反应器,热循环之后,反应被分成阳性或阴性,为数字格式输出提供了基础,同时通过确定空分区的比例,应用泊松统计估计目标分子的初始数量[37]。微滴式数字PCR(droplet digital PCR,ddPCR)作为一种新型核酸扩增技术已经得到了广泛的推广应用。魏咏新等[38]根据STEC O157:H7的特异性基因hly设计了引物探针,并利用纯菌液建立了一种ddPCR快速定量的检测方法。结果显示,该方法对人工污染食品样品的检出限为110 CFU/mL,与平板计数定量结果相近,适用于食品中高污染STEC O157:H7的定量检测。另外,STEC基因亚型众多,仅靠单一特异性基因引物无法满足广泛的检测需要,容易出现漏检的情况。对此,Yun等[39]设计了一种基于14种特异性引物的微流控薄膜芯片式检测方法。用此方法检测腹泻样品中的致泻性大肠埃希氏菌,能够高效精确地区分包括STEC在内的致泻性大肠埃希氏菌的不同亚型,且与mPCR等方法相比,该方法对PCR抑制效应的敏感性低得多,大大提高了检测的准确性和精密度。
3.2等温扩增技术
利用等温扩增技术检测食品中食源性致病菌具有灵敏度高、特异性强、快速便捷等优点,已被广泛应用于食源性致病菌的检测。其主要分为环介导等温扩增(Loop-mediated isothermal amplification,LAMP)、重组酶聚合酶扩增(Recombinase polymerase amplification,RPA)等。
3.2.1环介导等温扩增技术
环介导等温扩增技术具有灵敏度和特异性高、成本低等优点,在食品领域STEC检测方面得到了广泛应用。Wang等[40]基于特异性基因设计出了能够同时检测多种STEC的LAMP方法,将其用于检测人工污染STEC的牛肉样品,检测限可达到103~104 CFU/g。然而,食品基质中含有的其他杂菌会对LAMP检测STEC的准确性产生影响,且对样本进行预增菌虽然能够提高该方法的灵敏度,但预增菌时间消耗较长。为缩短前处理时间,可使用功能性磁珠对目标STEC菌株进行富集。磁珠分离法灵敏度高、特异性强,不会影响致病菌活性,适用于大体积及复杂本底背景的样品监测,且所需设备成本较低[41]。因此,Qin等[42]建立了一种将IMS分离与LAMP结合用于快速检验牛肉中STEC O157:H7的方法。结果发现,使用IMS方法,不仅可以缩短4 h的增菌培养时间,还能大大降低检测牛肉样品的检测限,可达到30 CFU/mL。另外,检测过程中难以区分“死菌”和“活菌”,容易出现假阳性结果,这是影响检测方法准确性的另一大原因[43]。细胞死亡后,由于DNA分子能保留较长时间,所以从样品中提取的死菌DNA同样能作为模板进行特异性扩增。而利用PMA染料能特异性区分活死菌的特性,将其与等温核酸扩增技术相结合,可有效降低检测出现假阳性结果的概率。Wen等[44]将上述两种解决方式与LAMP结合,并将其应用于检测人工污染STEC O157:H7生菜样品。结果发现,该方法不仅能够有效减少死菌的影响,而且使用IMS检测方法的灵敏度提高了10倍。
3.2.2重组酶聚合酶扩增技术
RPA通过重组酶使单链引物与双链引物DNA模板互补配对,启动DNA复制,且不需要DNA解链过程,引物设计相对简单,具有扩增速度快、准确度高等特点[45],近年来被广泛应用于STEC检测中。范一灵等[46]以stx1和stx2为靶点,设计并筛选出了适用于RPA检测的引物和探针,并将其应用于检测人工污染碎牛肉样品。结果显示,污染水平为10 CFU/25 g和1 CFU/25 g的样品的检测结果均为阳性,实现了快速高效检测。此外,与其他方法相似,结合IMS方法对目标STEC菌株进行富集,同样可缩短前处理时间,实现快速检测。王淑娟等[47]利用金属有机骨架免疫磁珠的富集功能,将其与多酶恒温核酸扩增荧光法结合用于STEC O157:H7的检测。该方法通过人为污染碎牛肉样品进行方法验证,同时还添加了其他食源性致病菌作为阴性对照。结果发现,在增菌6 h时,通过该功能性免疫磁珠即可在样品中检出STEC O157:H7,而不添加STEC O157:H7的阴性对照样品中未检出相关菌株。该方法表现出了在非特异性高背景杂菌污染情况下的高选择性,且可以在短时间内检出目标菌,为STEC的特异性分离富集和快速检测提供了新思路。
4其他检测方法
4.1腺苷三磷酸生物发光法
生物发光法的原理是从细胞中提取出的腺苷三磷酸(Adenosine triphosphoric acid,ATP)与荧光素酶发生荧光反应。ATP可作为活菌标志物,细胞内的ATP含量可以反映细胞的活性及数量。唐倩倩等[48]通过建立STEC O157:H7与光源计数值的定量线性模型,证实了ATP生物发光法与传统培养法间存在良好的线性关系。
4.2生物传感器
生物传感器是生物学和电子通信学等学科交叉结合发展形成的一种新型分析检测技术,现已被应用于食源性致病菌检测领域。该方法可缩短样品提取和检测结果出现的时间,且其本身不能独立鉴定菌种,与IMS、PCR等技术结合应用,检测效果良好。PARK等[49]以STEC O157:H7为目标菌,通过将PCR与微流控技术结合建立了一个无泵微流体芯片,检测限可低至102 CFU/mL。
4.3流式细胞术
流式细胞术是一种在功能水平上对单个细胞或其他生物粒子进行定量分析和分选的检测手段。将流式细胞仪方法和荧光染色结合应用能够客观评价菌体的活性状态。李影等[50]使用此方法对经过酸和低温联合诱导的活的非可培养大肠杆菌进行了检测。结果表明,当可培养的大肠杆菌数量为零时,仍有许多显示绿色荧光的活菌,结合荧光图像可观察其菌体形态。
5 STEC活菌检测方法的应用及局限性
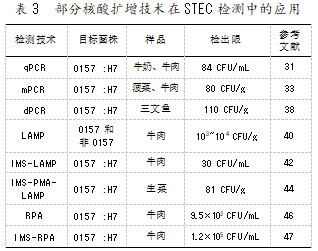
传统细胞培养方法灵敏度较高、操作简单,且易于使用,是评估STEC生存能力的“金标准”。而免疫学和分子学等检测技术的检测效率、灵敏度和特异性较高,已被广泛应用于食品中STEC的检测(见表2、表3)。

虽然这些方法已被广泛应用于食品检测领域,但其仍存在一些不足之处。第一,由于食品基质的异质性、菌体分布不均匀,以及目标菌在食品中含量较低,检测方法的灵敏度受到了限制。将IMS应用于样品前处理步骤中可有效富集目标STEC菌株,缩短培养增菌时间,但IMS方法同样也会造成漏检的情况[51-52]。第二,检测样品的背景菌种类及数量、增菌培养液类型、培养温度和时间等因素均会影响检测的灵敏度[53],仍需要大量试验结果来验证不同检测方法的稳定性。第三,部分核酸扩增技术无法区分DNA或RNA是来自活菌还是死菌,难以排除死菌引起的假阳性可能,导致单独使用该技术无法证明细胞活性。同时,利用PMA等生物染料可以进行活菌检测,但染料有一定的毒性,在样品处理中浓度使用不当可能会对活细胞造成损害。第四,STEC血清型及基因亚型种类繁多,为检测方法中的特异性引物和探针设计带来了巨大的挑战。
6结论及展望
本文对STEC活菌的检测方法进行了分类和总结,介绍了不同检测方法的应用范围及其优劣势,并对这些方法面临的问题进行了探讨。传统培养法作为检测的“金标准”,是许多新型检测技术发展的重要铺垫,引起了人们的广泛关注。而随着生物工程技术的发展,免疫学和分子生物学等检测方法与传统培养法相比,特异性更强、灵敏度更高且检测时间更短,拥有更为广阔的应用前景。与此同时,生物传感器、流式细胞术等其他新兴技术也正被应用于STEC检测。综上所述,不同检测方法的联合使用可克服单一方法的缺陷,在加快STEC检测速度的同时,可提高检测方法的灵敏度和准确性,对于保障食品安全及STEC后续更广泛的研究具有重要意义。
参考文献
[1]GRISARU S,SAMUEL S,XIE JL,et al.Associations between hydration status,intravenous fluid administration,and outcomes of patients infected with Shiga toxin-producing Escherichia coli:a systematic review and meta-analysis[J].Jama Pediatrics,2017,171(1):68-76.
[2]KOUTSOUMANIS K,ALLENDE A,ALVAREZ-ORDONEZ A,et al.Pathogenicity assessment of Shiga toxin-producing Escherichia coli(STEC)and the public health risk posed by contamination of food with STEC[J].EFSA Journal,2020,18(1).Dot:10.29031j.etsa.2020.5967.
[3]Burger R(2012)EHEC O104:H4 in Germany(2011):large outbreak of bloody diarrhea and haemolytic uraemic syndrome by Shiga toxin-producing E.coli via contaminated food.Improving food safety through a one health approach:workshop.Institute of medicine(US).Washington(DC):National Academies Press(US).En:https://www.ncbi.nlm.nih.gov/books/NBK114499/
[4]中华人民共和国国家卫生和计划生育委员会;国家食品药品监督管理总局.食品安全国家标准食品微生物学致泻大肠埃希氏菌菌检验:GB 4789.6-2016[S].北京:中国标准出版社,2016.
[5]FRATAMICO P M,BAGI L K,CRAY W C,et al.Detection by multiplex real-time polymerase chain reaction assays and isolation of Shiga toxin producing Escherichia coli serogroups o26,o45,o103,o111,o121,and o145 in ground beef[J].Foodborne Pathogens&Disease,2011,8(5):601-607.
[6]International Organization for Standardization(ISO)(2012).Microbiology of food and animal feed—Real-time polymerase chain reaction(PCR)-based method for the detection of food-borne pathogens—Horizontal method for the detection of Shiga toxin-producing Escherichia coli(STEC)and the determination of O157,O111,O26,O103 and O145 serogroups.ISO/TS13136:2012(E)(1st ed.).Geneva:International Organization for Standardization.
[7]ZHAO X,LIN C W,WANG,et al.Advances in rapid detection methods for foodborne pathogens[J].Journal of Microbiology&Biotechnology,2014,24(3):297.
[8]GUERINI MN,ARTHUR TM,SHACKELFORD SD,et al.Evaluation of Escherichia coli O157:H7 growth media for use in test-and-hold procedures for ground beef processing[J].Journal of Food Protection,2006,69(5),1007-1011.
[9]LQAS/FSIS.MLG 5B.04-Detection and Isolation of non-O157 Shiga Toxin-Producing Escherichia coli(STEC)from Meat Products and Carcass and Environmental Sponges[J].2013.
[10]REINDERS RD,BARNA A,LIPMAN L,et al.
Comparison of the sensitivity of manual and automated immunomagnetic separation methods for detection of Shiga toxin producing Escherichia coli O157:H7 in milk[J].Journal of Applied Microbiology,2002,92(6):1015-1020.
[11]GILL A,MARTINEZ-PEREZ A,MCILWHAM S,et al.Development of a method for the detection of verotoxin-producing Escherichia coli in food[J].Journal of Food Protection,2012,75(5):827.
[12]胡颖,赵琳娜,白莉,等.前增菌抗生素添加对产志贺毒素大肠埃希氏菌分离的影响[J].中国食品卫生杂志,2022,34(3):504-506.
[13]GRANT MA.Improved laboratory enrichment for e nterohemorrhagic Escherichia coli by exposure to extremely acidic conditions[J].Applied and Environmental Microbiology,2004,70(2):1226-1230.
[14]GRANT MA.Comparison of a new enrichment procedure for Shiga toxin-producing Escherichia coli with five standard methods[J].Journal of Food Protection,2005,68(8):1593-1599.
[15]GRANT MA.Comparison of Escherichia coli O157:H7 enrichment in spiked produce samples[J].Journal of Food Protection,2008,71(1):139-145.
[16]LAMPARTER C M,SEEMANN A,HOBE C,et al.Using hydrochloric acid and bile resistance for optimized detection and isolation of Shiga toxin-producing Escherichia coli(STEC)from sprouts[J].International Journal of Food Microbiology,2020,322:108562.
[17]李琼琼,宋明辉,蒋波,等.基于酸处理的产志贺毒素大肠埃希菌选择性增菌方法研究[J].食品安全质量检测学报,2021,12(17):6843-6850.
[18]BETTELHEIM KA.Reliability of O157:H7 ID agar(O157 H7 ID-F)for the detection and isolation of verocytotoxigenic strains of Escherichia coli belonging to serogroup O157[J].Journal of Applied Microbiology,2005,99(2):408-410.
[19]MARCH SB,RATNAM S.Sorbitol-MacConkey medium for detection of Escherichia coli O157:H7 associated with hemorrhagic colitis[J].Journal of Clinical Microbiology,1986,23(5):869-872.
[20]PAO S,PATEL D,KALANTARI A,et al.Detection of Salmonella strains and Escherichia coli O157:H7 in feces of small ruminants and their isolation with variousmedia[J].Applied&Envirormental Mierobiology,2005,71(4):2158-2161.
[21]李晓虹.利用EHEC琼脂平板从食物中分离检测产志贺季素大肠杆菌[J].中国食品学报,2006,6(5):137-139.
[22]范如岳.非0157产志贺季景大肠埃希菌分离方法的评价和优化[D].北京:中国疾病预防控制中心,2018.
[23]HAMZEHLOU 8S,FARAJOLLAHI MM Bstablishment ofa new imumological mathod for direct detection ofMycobacterium in solution[Il.Jourmal of MicrobiolcgyInmumology,and Infection,2016,49(1):97-103.
[24]造晓杰,李天添,董锐,等.Tecra”(TM)大肠杆菌0157醇联免疫快速方法与经典培养方法的比较及其应用评价[J]。中国初级卫生保健。2012(12):38-40.
[25]ZHAO Y,ZENG D,YAN C,et al.Rapid and accuratedetection of Escherichia coli 0157:H7 in beef usingmicrofluidic wax-printed peoer-based ELIsA[Il.TheAnalyst,2020,145(8):3106-3115.
[26]陈明意.快速检测猪肉中大肠杆菌0157:H7胶体金免疫层析试纸条的研究[D].南昌:南昌大学,2015.
[27]王宗汉.基于新型免标记探针的肠炎沙门氏菌和大肠杆菌0157:H7免疫层析检测方法研究[D].成阳:西北农林科技大学,2020.
[28]WANG Z,CAI R,GAO Z,et al.Immomazneticseparation:An effective pretreatment technolosr forisolation andenrichment in food microorganismsdetection[Jl.Comprehensive Reviews in Food Science anFood Safety,2020,19(6):3802-3824.
[29]HUANG Z,PENG J,HAN J.et al.A novel methodbased on fluorescent maznetic nanobeads for rapiddetectionof Escherichiacoli0157:H7[J]l.Food Chemistr,2019,276:333-341.
[30]文湘都,膝鑫,丁星字,等.一种新型检测大肠杆菌0157:H7的免疫磁珠-量子点纳米颗粒的制各和应用[J].食品与发酵工业,2022,48(13):7.
[31]魏婉晴,孔梁字,胡瑞瑞,等.大肠杆菌0157:H7实时荧光定量PCR快速检测试剂盒的组建及活菌检测[J].现代食品科技,2022,38(1):10.
[32]SINGH P,LIU Y,BOSILEVA JM et al.Detection ofShiga toxin-producing Escherichia coli,stx,stx andSalmomella by two hizh resolution malt curve multiplexreal-time PCR[J].Food Control,2018,96:251-259.
[33]XIE G,YU S,LI W,et al.Simultaneous detection of Salmonella spp.,Pseudomonas aeruginoes,Bacillus cereus,and Escherichia coli 0157:H7 in anvirormantalwater using PMA ccabined with mPCR[Jl.Jourmal ofMicrobiology,2020,58:668-674.
[34]LI B,LIU H,WANG W.Multiplex real-time PCR assayfor detection of Escherichia coli 0157:H7 and serwnirgfor non-0157 Shiga toxin-producing E.coli[J].BMCMicrobiology,2017,17(1):215.
[35]SCHEUTZ F,TEEL LD,BEUTIN L,et al.Multicenterevaluation of a sequence-based protocol for subtypingShiga toxins and standardizing stx nomenclature[Il.Joumal of Clinical Microbiology,2012,50(9):2951-2963.
[36]HU Y,BAI L,ZHAO L,ot al.Standardized Shiga-toxinencoding genes real-time PCR screening methodsconparisonanddevelopmantofanintemallycontrolled assay for pan-stx detation[Jl.Jourralof AOACIntermational,2021,104(4):1065-1071.
[37]WILKES T,ELLISON S.dPCR-the digital polymerasechain reaction[J].Analytical Methods,2017,9(29):4225-4227.
[38]魏咏新,马丹,李丹,等.食品中Bscherichia coli 0157:H7微滴数字PCR绝对定量检测方法的建立[J]。食品科学,2020,41(16):259-265.[39]YUN Z,ZENG L,HUANG W,et al.Detection andcategorization of diarrheagenic Escherichia coli withauto-microfluidic thin-film chip method[J].ScientificReports,2018,8(1).
[40]WANG F,JIANG L,YANG Q,et al.Rapid and specificdetection of Escherichia coli serogroups 026,045,0103,0111,0121,0145,and 0157 in ground beef,beef trim,and produce by loop-mediated isothermalamplificaticm[Jl.Applied andEnviramantal Microbiology,2012,78(8):2727-2736.
[41]KIM JH,OH SW.Pretreatment methods for nucleicacid-based rapid detection of pathogens in food:Areview[Jl.Food Control,2021,121(12):107575.
[42]QIN Y,PUTHIYAKUNNON S,ZHANG Y,et al.Rapidand specific detection of Escherichia coli 0157:H7 inground bef using immmcmagnetic separation ccmbinedwith loop-mediated isothermal amplification[J].PolishJourmal of Food and Nutrition Seiences,2018,68(2):115-123.
[43]RANDAZZO W,KHEZRI M,OLLIVIER J,et al.Optimization of PMxx pretreatment to distinguishbetween human norovirus with intact and altered capsids in shellfish and sewage samples[J].International Journal of Food Microbiology,2018,266:1-7.
[44]WEN Y,TAN Y,ZHAO L,et al.Rapid on-site detection of viable Escherichia coli O157:H7 in lettuce using immunomagnetic separation combined with PMAxx-LAMP and nucleic acid lateral flow strip[J].Microchemical Journal,2022,178:107348.
[45]PIEPENBURG O,WILLIAMS CH,STEMPLE DL,et al.DNA detection using recombination proteins[J].Plos Biology,2006,4(7):1115-1121.
[46]范一灵,王淑娟,李琼琼,等.重组酶聚合酶扩增检测产志贺毒素大肠埃希菌的微流控芯片技术[J].食品科学,2021,42(10):297-304.
[47]王淑娟,范一灵,冯震,等.多酶恒温核酸快速扩增法检测大肠杆菌O157:H7[J].上海预防医学,2022,34(6):8.
[48]唐倩倩,王剑平,盖玲,等.ATP生物发光法检测E.coliO157:H7的研究[J].光谱学与光谱分析,2009,29(2):309-312.
[49]PARK YM,PARK J,LIM S Y,et al.Integrated pumpless microfluidic chip for the detection of foodborne pathogens by polymerase chain reaction and electrochemical analysis[J].Sensors and Actuators B:Chemical,2021,129:130.
[50]李影,王伟利,段冶,等.流式细胞仪检测活的非可培养状态大肠杆菌[J].中国动物检疫,2009,26(12):34-36.
[51]O'BRIEN SB,DUFFY G,DALY D,et al.Detection and recovery rates achieved using direct plate and enrichment/immunomagnetic separation methods for Escherichia coli O157:H7 in minced beef and on bovine hide[J].Letters in Applied Microbiology,2010,41(1):88-93.
[52]LEJEUNE JT,HANCOCK DD,BESSER TE.Sensitivity of Escherichia coli O157 detection in bovine feces assessed by broth enrichment followed by immunomagnetic separation and direct plating methodologies[J].Journal of Clinical Microbiology,2006,44(3):872-875.
[53]TUTENEL AV,PIERARD D,VANDEKERCHOVE D,et al.Sensitivity of methods for the isolation of Escherichia coli O157 from naturally infected bovine faeces[J].Veterinary Microbiology,2003,94(4):341-346.










