人参酵素皂苷含量的分析研究论文
2024-04-29 10:38:49 来源: 作者:liyuan
摘要:人参酵素是以人参作为主要原料,经过发酵产生的一种红棕色的液体,不但可以预防多种 疾病,而且在美容方面发挥着非常重要的作用。人参是营养价值极高的一种植物资源,具有非常强 大的滋补能力,研究发现,人参中可以分离出多种皂苷和多糖,它们是人参生理活性的物质基础。文 章主要研究人参酵素中皂苷含量,分别使用 pH 试纸和 pH 计测定人参酵素的酸碱度;使用分光光 度计在 400~700 nm 波长之间对人参皂苷 Re 进行光谱分析,得到 550 nm 是其最大吸收波长,然后 在 550 nm 的波长下以人参皂苷 Re
摘 要:人参酵素是以人参作为主要原料,经过发酵产生的一种红棕色的液体,不但可以预防多种 疾病,而且在美容方面发挥着非常重要的作用。人参是营养价值极高的一种植物资源,具有非常强 大的滋补能力,研究发现,人参中可以分离出多种皂苷和多糖,它们是人参生理活性的物质基础。文 章主要研究人参酵素中皂苷含量,分别使用 pH 试纸和 pH 计测定人参酵素的酸碱度;使用分光光 度计在 400~700 nm 波长之间对人参皂苷 Re 进行光谱分析,得到 550 nm 是其最大吸收波长,然后 在 550 nm 的波长下以人参皂苷 Re 作为标准品测定其吸光度,再计算人参酵素中的皂苷含量;pH 计测出人参酵素呈酸性,pH 为 3.68;人参总皂苷在 0~100 uL 范围内线性关系相对良好,SRSD(相对 标准差)为 2.1%(n=3),结果显示人参酵素中皂苷含量为 0.2 mg/mL。由以上实验结果可知,酵素是 一种酸性的液体,易于保存。人参皂苷是人参酵素中的主要活性物质,保留了人参的生物活性。
关键词:人参酵素;皂苷含量
1 人参概述
1.1 人参简介
人参的根部非常大,外形和纺锤类似,表面有非 常多的分支,与人类的四肢相似,所以被人们称为 “人参”。它是一种药食同源的植物资源,具有强大 的滋补效果,被人们称为“百草之王”,是貂皮、鹿茸 之外的闻名遐迩的“东北三宝”之一,是驰名中外、老 幼皆知的名贵药材。现代技术研究表明,人参分离 出 30 多种皂苷、多糖,它们是人参生理活性的物质 基础。
1.2 人参的化学成分
1.2.1 人参皂苷成分
医学和药理的研究证明,人参的主要有效成分 之一—人参皂苷,是人参根部主要的生理活性物 质。我国的科技人员和技术人员现已从国产人参根 中分离出 Re、Rf、Rg2 等 10 种人参皂苷[1],并且从人 参茎叶中分离出 Rbl、Rd、Re 等 14 种单体,从人参的果子中分离出 Rb1、Rb2、Rc、Rd、Re 等 8 种人参 皂苷单体[2]。
1.2.2 人参多糖成分
人参含有的糖类成分主要是单糖、低聚糖和多 糖,有一定生理活性的人参糖类成分为人参多糖。人 参多糖主要含酸性杂多糖和葡萄糖[3] 。这些人参多 糖都含有一定量的多肽,这些人参糖肽为人参中天 然存在的生物活性物质。
1.2.3 其他成分
人参中还含有大量可以挥发的油、多种氨基酸 与微量元素、维生素和酶、人参皂苷、麦芽酚、腺苷等 活性物质[4]。

2 酵素概述
2.1 酵素简介
酵素是酶的另一个名字,它的很多性质和功能 都和酶类似,它是由多种氨基酸组成的具有特殊生 物活性的物质,又名植物综合性酶。酵素分为狭义酵素和广义酵素。狭义酵素单指酶,广义酵素指酶和 产酶微生物及其相关调节因子,主要强调微生态整 体[5]。2016 年,中国微生物发酵产业协会制订了酵素 团体标准,规定酵素是以蔬菜、水果、中药材等为原 料,经微生物发酵制得的含有生物活性成分的产品。 酵素发酵的过程非常复杂,包括微生物与微生物、微 生物与底物、底物与底物之间的相互作用。微生物 在发酵的同时也会增加一些新的功能,使酵素具有 保健价值。
2.2 酵素的相关研究——酵素发现
在辞海中,酵素是酶的旧称。酶本身是个近现 代的概念,而“酵”的渊源较早,如北宋末年朱肱《北 山酒经》中的“用酵四时不同,寒即多用,温即减之”。 可见,“酵”有酵母之意,故从字面上理解,酵素即酵 母之要素。酶(enzyme)是德国科学家毕希纳通过破 碎酵母细胞最终确认的,故有存在于(en)酵母 (zyme)中的要素之意。酵素是各种生化反应的催化 剂,能通过降低反应的活化能加快反应速度,但不改 变反应的平衡点,具有催化效率高、专一性强、作用 条件温和等特点。所以,酵素的保存需要考虑温度 和酸碱度,高温和低温都可能影响酵素的保存,破坏 酵素的功能。
2.3 探究酵素对研究本课题的意义
随着时代的进步,我们的生活水准在不断提高 的同时,我们的生活环境也在不断被污染。一些报 道称,现在人类出现的很多非常奇怪的疾病,都是由 于人们不良的生活习惯和较大的精神压力引起的。 国内外专家的研究表明,酵素在保护人类身体健康 方面有很大的功效,可以预防多种疾病。因为酵素 大多是由水果或者蔬菜发酵而成的,所以酵素被称 为天然无添加的物质,深受人们喜爱。
3 人参酵素的理化指标测定
3.1 人参酵素酸碱度测定
3.1.1 实验材料与仪器
实验材料:人参酵素,pH 试纸,玻璃棒,比色卡, 表面皿,胶头滴管,pH 计,烧杯,pH 6.68 的标准液, pH 4.00 的标准液,去离子水,滤纸,温度计。
3.1.2 实验方法
pH 试纸测定酸碱度范围 取洁净的玻璃棒沾取微量人参酵素,滴在 pH 试纸上,观察试纸的颜色 变化。按照同样的方法,用不同 pH 范围的试纸测 定,观察颜色的变化。然后将试纸的颜色对照比色 卡,判断人参酵素的 pH 范围。
pH 计测定人参酵素酸碱度 校准液 A:pH 为 6.86 的液体;校准液 B:pH 为 4.00 的液体。
第一步:测量校准液 A 的温度,看 pH 上的温度 是否和温度计上示数一样,不一样就进行温度补偿, 将温度调到一致。
第二步:测后要用提供的清洗液将电极浸入洗 净,使用滤纸将电极清洁,再盖上盖子。
第三步:在烧杯中倒入校准液 A 4 mL,用于冲 洗电极和烧杯。往烧杯中倒入 15 mL 的校准液 A, 将电极浸入校准液 A 中,若 pH 计的示数不是已知 溶液的 pH,则进行调节,直到 pH 一致并且保持稳 定。
第四步:测后要用提供的清洗液将电极浸入洗 净,再使用滤纸将电极清洁。测量校准液 A 的温度, 然后看 pH 上的温度是否和温度计上示数一样,如 果不一样就进行温度补偿,将温度调到一致。
第五步:在烧杯中倒入已知校准液 B 4 mL,用 于冲洗电极和烧杯。再往烧杯中倒入 15 mL 的校准 液 B,将电极浸入校准液 B 中,若 pH 计的示数不是 已知溶液的 pH,则进行调节,直到 pH 一致并且保 持稳定。
第六步:使用温度计测定人参酵素的温度,看 pH 上的温度是否和温度计上示数一样,如果不一样 就进行温度补偿,将温度调节到一致。
第七步:最后将电极插入人参酵素中,读取 pH 计上的示数,即为人参酵素的 pH。
3.1.3 实验结果与分析
使用 pH 试纸测定人参酵素的酸碱度,通过比 色卡对比,粗略估计人参酵素的 pH 范围在 2.7~5.4 之间,呈酸性。使用 pH 计测定酵素的酸碱度结果为 3.68。
3.2 人参酵素中的皂苷含量测定
3.2.1 实验材料与仪器
实验器材:烧杯,玻璃棒,量筒,一次性滴管,铁 架台,100 mL 的容量瓶,称量纸,标签纸,具塞试管, 移液枪,分液漏斗,烧瓶。
实验试剂:人参酵素,香草醛,高氯酸,甲醇,酒 精,正丁醇,乙醚,人参皂苷 Re 标准品,冰醋酸。
3.2.2 实验方法
实验原理 用香草醛比色法测定人参酵素中的 皂苷含量,为了使检测的结果准确,我们要在香草醛 中加入高氯酸。
溶液配制 2 mg/mL 人参皂苷溶液:准确称量人 参单体皂苷 Re 10 mg,放入 5 mL 的容量瓶里,加甲 醇溶解并稀释至刻度。
70% 乙醇:将无水乙醇与纯水按 7 ∶3 的体积 比混合,按量调配。
5% 香草醛—冰醋酸溶液:用精密天平称 5 g 的 香草醛粉末,然后用冰醋酸稀释到 100 mL。
水饱和的正丁醇,正丁醇饱和的水:在干净的烧 杯中依次加入蒸馏水和正丁醇,立即出现分层的现 象。此时下层的是正丁醇饱和的水溶液,记作 A 液, 上层的是水饱和的正丁醇溶液,记作 B 液。
实验步骤 样品溶液的制备:取人参酵素样品 10 mL,倒入烧瓶中。将烧杯放在旋转蒸发器上,将 水温度调节在 70℃ ,使酵素在烧瓶中挥发蒸干(注: 旋转蒸发器时的速度应尽量慢,以保证受热均匀,旋 转蒸发器的蒸发速度很快)。蒸干后应先打开气阀 排气,再取下烧瓶,加入 5 mL 的 A 液,将蒸干后的 残留物在超声机里面超声水浴使其溶解,数分钟后, 溶解完全,倒入容积 100 mL 的烧杯中。用 50 mL 的 B 液对超声后的溶液进行萃取操作, 每次萃取 30min,重复操作 4 次,将 4 次操作中分液漏斗的上 层清液混合在一起,用 B 液再进行一次萃取,一共 进行 5 次萃取。将 5 次萃取后的液体混合在一起, 一次性全部倒在旋转蒸发器中挥发蒸掉,而后使用 少量的甲醇先将蒸掉后的残渣溶解,再加甲醇到容 量瓶的 10 mL 刻度处。
通过对人参皂苷 Re 在波长 400~700 nm 之间 进行光谱扫描,确定它的最大吸收波长,找到光谱达 到波峰时的波长为 550 nm。
标准曲线绘制:取编号 1~6 的 6 支带有塞子的 洁净玻璃试管,用移液枪精确吸取 0 mL、0.02 mL、 0.04 mL、0.06 mL、0.08 mL、0.1 mL 的质量浓度为 2 mg/mL 人参皂苷溶液,依次加入 6 支试管中。将 6 只 试管放在 70℃的水浴中使液体挥发干净,最后试管里剩下极少量的粉末。用流水使试管温度降下来,冷 却后用移液枪向 6 支试管中都加入 0.2 mL 配制好 的香草醛冰醋酸溶液、0.8 mL 的高氯酸,立刻机械 摇匀,盖上塞子,在 60 ℃的恒温水浴中水浴一刻钟, 马上冷却,再加入冰乙酸 5.0 mL,机械摇匀后,用加 入的试剂作为空白对照组,在分光光度计中测定吸 光度。
3.2.3 实验结果与分析
标准曲线绘制操作下测定的吸光度如表 1。
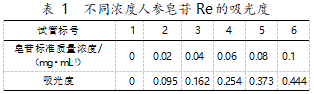
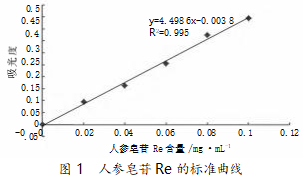
以人参皂苷的含量作为标准曲线的横坐标,不 同含量对应的吸光度作为标准曲线的纵坐标,画出 标准曲线(如图 1),得回归方程:y=4.498 6x-0.003 8,R2=0.995。
样品溶液稳定性试验取样品溶液,进行比色,每 间隔 10 min 测定一次吸光度,测定 30 min 内的吸 光度(如表 2)。
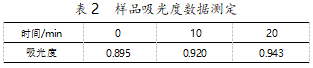
数据表明,实验样品溶液在实验中具有稳定性。
按“标准曲线绘制”下的操作来测定样本溶液的吸光度,再把吸光度带入人参皂苷的标准曲线测出 来的回归方程,算出相应的人参总皂苷含量。取稳 定性实验中三次测定吸光度的平均数,查到其产生 的皂苷含量为 0.20 mg/mL。
本实验是通过分光光度计进行测定的,先检测 出人参皂苷单体 Re 的标准品和配置的样品溶液在 一定波长范围内的最大吸收波长。配置不同含量的 人参皂苷单体 Re 的标准品,做出一条标准曲线,将 人参皂苷 Re 的含量作为标准曲线的横坐标,所测 定的吸光度作为标准曲线的纵坐标,回归方程为 y= 4.498 6x-0.003 8,R2 =0.995。再测样品溶液的吸光 度,本实验共测了三次样品溶液的吸光度,每隔 10min 测一次,吸光度近似处于稳定,取三次吸光度 的平均值,带入回归方程,算出对应的皂苷含量 x 值。
4 结论
通过温度补偿和标准液校准,我们可以确定 pH 计测定的人参酵素的 pH 是一个相对准确的值,且 人参酵素的 pH 为 3.68,呈酸性。我们人体食用的酸 性食品,可以疏通和软化血管,也可以清洁杀菌,增强人体免疫力。
酵素是发酵的产物。经测定,人参酵素中存在较 低的酒精度。所以在食用人参酵素时应谨慎,酒精过 敏的人慎用。
本次实验所得的人参皂苷 Re 标准曲线较为精 确,可以很好地表现不同含量的人参皂苷在 550 nm 处的吸光度的变化规律。每隔 10 min 测定样品溶液 在 550 nm 波长下的吸光度,显示吸光度较为稳定, 所以实验结果可靠,结果测得样品中的人参酵素含 量为 0.2 mg/mL。
参 考 文 献
[1] 许蓬娟, 李悠悠, 孙梓翔. 酵素在生物作用中的研究进 展[J]. 食品与发酵科技, 2017, 53(1): 83-85,97.
[2] 乐春生, 高萌, 潘文波. 城市社区健康教育与健康促进[J]. 长江大学学报(自科版), 2016, 13(12): 68-70.
[3] 荣智兴, 戴智勇, 张岩春, 等. 营养保健食品行业概况 [J]. 食品工业科技, 2015, 36(21): 30-32.
[4] 陈福民. 说说酵素与酶[J]. 化工管理, 2014(34): 70-73.
[5] 陈书华, 姜旭, 张念洁. 人参果蔬酵素中人参皂苷含量 的测定[J]. 食品研究与开发, 2016, 37(5): 114-116.










