离子液体电解液促进电催化 CO2 性能研究论文
2025-10-29 15:06:03 来源: 作者:xuling
摘要:铜基催化剂因其独特的*CO中间体耦合能力,成为CO 2RR领域的研究焦点。然而,传统铜基催化剂在水性电解液中面临选择性低、稳定性差等问题。
摘要:铜基催化剂因其独特的*CO中间体耦合能力,成为CO 2RR领域的研究焦点。然而,传统铜基催化剂在水性电解液中面临选择性低、稳定性差等问题。本研究通过调控1-丁基-3-甲基咪唑四氟硼酸盐与水的混合比例,探究其对铜基催化剂电催化CO 2还原性能的影响。实验结果表明,电解液中适量的水能够显著提高电解液的电导率和CO2的溶解度,优化反应动力学,抑制析氢反应,并提升含碳产物的选择性。通过电化学测试和产物分析,发现n(BmimBF4)∶n(H2O)=1∶5的电解液体系在CO2还原反应中表现出最高的电流密度和法拉第效率,尤其是甲酸、甲醇和乙醇的生成显著增加。本研究为开发高效、稳定的CO 2RR电解液体系提供了理论依据和实验支持。
关键词:CO2RR;离子液体;电解液比例;含碳产物
0引言
全球气候变暖与能源危机背景下,二氧化碳(CO2)的高效资源化利用已成为实现“双碳”目标的核心挑战之一[1]。电催化CO2还原(CO2RR)技术通过可再生电力驱动CO2转化为高附加值燃料或化学品(如甲醇、乙醇等),为碳循环闭合提供了极具潜力的解决方案[2]。在众多催化剂中,铜基材料因其独特的*CO中间体耦合能力,是目前唯一可实现单碳及多碳产物高效生成的金属催化剂,被视为CO2RR领域的研究焦点[3]。然而,传统铜基催化剂在常规水性电解液中面临选择性低、稳定性差等瓶颈问题[4]。一方面,析氢反应(HER)的激烈竞争导致含碳产物法拉第效率(FE)难以突破[5];另一方面,催化剂表面重构、氧化或溶解等问题严重限制了其长期运行能力[6]。因此,如何通过电解液调控反应界面微环境,成为提升铜基催化剂性能的关键突破口。
近年来,离子液体(Ionic Liquids,ILs)因其独特的物理化学性质(如低蒸气压、宽电化学窗口、可设计的阴阳离子结构)在电催化领域备受关注。研究表明,离子液体可通过增强CO2溶解度、调控双电层结构、稳定关键反应中间体等方式显著提升CO2RR活性与选择性[7]。同时,其低质子活性还可抑制HER副反应。然而,纯离子液体体系存在黏度高、传质受限、成本较高等问题,限制了其实际应用。近年来,研究者发现将离子液体与水按比例混合可有效平衡两者的优势,水分子可降低电解液黏度、提高离子电导率,而离子液体则通过调控界面环境维持对CO2的高效活化[8]。尽管如此,离子液体与水的最优配比及其对铜基催化剂性能的影响机制仍不明确。
基于此,聚焦离子液体与水混合电解液的比例调控,探究其对CO2RR电化学性能的优化机制。通过设计不同体积比的1-丁基-3-甲基咪唑四氟硼酸盐(BmimBF4)和H2O混合电解液体系,结合电化学性能测试(如Tafel斜率、稳定性评估、法拉第效率等)揭示电解液比例对铜催化剂表面反应动力学及产物选择性的影响规律。本研究旨在为开发高效且适用于工业级电流密度的CO2RR电解液体系提供理论依据与实验支撑,推动电催化CO2资源化技术的实际应用。
1实验方法
1.1实验试剂及材料
氢氧化钾(KOH)、硫化钠(Na2S·9H2O)、硝酸银(AgNO3)、乳酸(C3H6O3)、十六烷基三甲基溴化铵(CTAB)、硫酸(H2SO4),上海阿拉丁生化技术有限公司;1-丁基-3-甲基咪唑四氟硼酸盐(BmimBF4),天津科密欧化学试剂有限公司;二氧化碳气体(CO2)、氩气气体(Ar)和氮气气体(N2),保定京联气体厂;泡沫铜,厚度2 mm,昆山绿创电子科技有限公司;去离子水为实验室所制备的高纯水。
1.2催化剂的合成
将尺寸为1 cm×1 cm×2 mm的泡沫铜在0.5 mol/L H2SO4溶液中浸泡30 min,以去除表面杂质。将处理后的泡沫铜作为工作电极,置于碱性电解液(3.2 mol/L KOH、2.3 mol/L乳酸、0.1 mol/L Na2S·9H2O)中,施加-0.16~-0.76 V vs.Ag/AgCl的线性循环电位,扫描速率5 mV/s,循环10次,以在电极表面形成硫化铜结构。在已修饰的电极表面滴加AgNO3溶液,并在红外灯(IR)下干燥。接下来在阳极池为0.5 mol/LH2SO4溶液,阴极池为物质的量比1∶3的BmimBF4/H2O溶液的体系中,通入CO2使其饱和,并施加-1.56 V vs.Ag/AgCl恒电位极化30 min,得到本实验使用的Ag,S-Cu2O/Cu催化剂。
1.3电解液的配置
不同比例的离子液体电解液被精确配制,以研究其在电化学CO2还原反应过程中的影响。首先,所使用的离子液体为BmimBF4,在其中加入了不同量的去离子水,形成具有不同水含量的离子液体-水混合体系。纯离子液体电解液:即未掺水的高纯BmimBF4,其作为基准体系用于对比研究加入水的影响。n(BmimBF4):n(H2O)=1:1电解液:将等摩尔比的去离子水与BmimBF4混合,并充分搅拌,使其形成均匀稳定的双组分电解质体系,以研究离子液体在较低水比例环境下的CO2还原催化特性。n(BmimBF4):n(H2O)=1:5电解液:进一步提高水含量,并充分搅拌,使其形成均匀稳定的双组分电解质体系,以研究离子液体在较高水比例环境下的CO2还原催化特性。
1.4材料表征
X射线光电子能谱(XPS,K-ALPHA,Thermo Fisher Scientific)在250Xi光谱仪上进行,采用单色铝辐射源(1486.6 Kα,通过能量20.0 Kα),利用C1s标准峰(284.8 eV)校正。X射线衍射(XRD,D8 AD-VANCE,Bruker Optics)的靶材为Cu靶,测试模式为广角衍射(5。~85o)。利用XPS和XRD证明催化剂的成功合成及Ag、S元素的成功掺杂。
1.5电化学测试
基于CS350H电化学工作站,在H型电解池中对CO2还原反应过程中的电化学特性进行了系统研究。采用线性循环伏安法(CV),在Ar和CO2气氛下分别测试了CO2RR的电催化活性。利用线性扫描伏安法(LSV)所测得的Tafel斜率评估了反应的动力学特性。此外,结合电化学阻抗谱(EIS)所绘制的奈奎斯特图,研究了CO2还原过程中电荷转移和传质过程的阻抗行为。产物分析方面,采用气相色谱仪(GC)检测气体产物,核磁共振氢谱(1H NMR)用于检测液态产物。基于法拉第效率(FE)及偏电流密度评估CO2还原过程中产物的选择性。
电化学测试具体实验参数如下:CV测试在-1.5~0 V(vs.Ag/AgCl)范围内进行,扫描速率设定为50 mV/s。LSV测试采用相同的电位区间(-1.5~0 Vvs.Ag/AgCl),扫描速率设定为10 mV/s,以确保数据的稳定性并减少电流响应中的噪声。EIS测试采用0.1~104 Hz的频率范围,施加5 mV的振幅以评估界面电荷转移和传质特性。此外,恒电位电解(CPE)在-1.8 V(vs.Ag/AgCl)下持续5 h,用于记录I-t曲线,以评估催化剂的稳定性及长期反应特性。为确保实验数据的可比性和标准化,所有测量电位均通过以下公式(1)转换至可逆氢电极(RHE)标准,以便于不同实验体系之间的对比分析。

2结果与讨论
2.1催化剂表征
图1显示了Ag,S-Cu2O/Cu催化剂的X射线光电子能谱(XPS)全谱,用以分析Ag、S-Cu2O/Cu催化剂的元素组成及其化学状态。从XPS全谱可以观察到多个主要元素的特征峰,包括Cu 2p、Cu Auger、Ag 3d、S 2p、O 1s、N 1s、C 1s、B 1s和F 1s等。其中,Cu 2p1和Cu 2p3的特征峰表明催化剂中存在不同氧化态的铜,这可能对于CO2RR的活性具有重要影响。Ag 3d峰的存在表明Ag的成功掺杂,有助于调控电子结构,增强催化选择性。S 2p峰确认了硫元素的存在,影响催化剂的表面化学性质。O 1s来源于金属氧化物,而C 1s、N 1s、B 1s和F 1s峰可能源自离子液体BmimBF4的部分残留。整体而言,该XPS全谱表明Ag、S-Cu2O/Cu催化剂具有较为复杂的化学环境,不同元素之间的相互作用可能在CO2还原反应过程中起到关键作用。
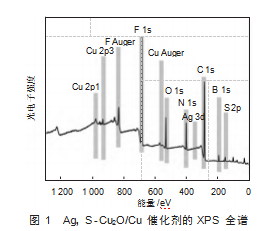
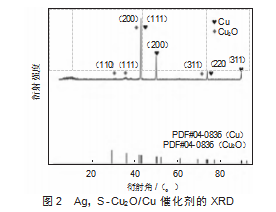
图2显示了Ag,S-Cu2O/Cu催化剂的X射线衍射(XRD)。XRD图谱显示了Cu和Cu2O的特征峰,表明催化剂中同时存在金属铜和氧化亚铜相。Cu的特征峰位于(111)、(200)、(220)和(311)晶面,对应于金属铜(PDF#04-0836)。Cu2O的特征峰位于(110)、(111)、(200)和(311)晶面,对应于氧化亚铜(PDF#05-0667)。Cu(111)晶面峰强度较高,金属Cu的(111)晶面可能在CO2还原反应中起主导作用。Cu2O的多个特征峰的存在证明了催化剂表面存在氧化态铜,这部分氧化态铜可能与催化剂的稳定性及其电化学活性息息相关。Ag,S-Cu2O/Cu催化剂具有Cu和Cu2O的混合晶相,促进了CO2电催化还原,在调控中间体吸附和电子转移过程中起到关键作用。
2.2电化学测试结果
图3展示了不同n(BmimBF4):n(H2O)比例电解液在氩气(Ar)气氛下的循环伏安曲线(CV-50 mV/s),其中横坐标为电位(V vs.RHE),纵坐标为电流密度(mA/cm2)。纯BmimBF4电解液条件下表现出较低的电流密度,此体系的电化学活性较低。在无水条件下的整个电位范围内,没有明显的氧化还原峰,仅表现出典型的双电层行为,离子液体的导电性和反应性受限。在适量引入水n(BmimBF4):n(H2O)=1:1电解液条件下)后,电流密度明显增大。在正负电位方向,电流密度增加,由于水的加入促进了电极界面处的离子迁移,降低了电荷转移阻力,影响了体系的氧化还原特性。n(BmimBF4):n(H2O)=1:5电解液条件下,电流密度进一步增加,体系的电化学活性增强。在负电位(<-0.8 V)下,n(BmimBF4):n(H2O)=1:5电解液条件下的曲线相较于n(BmimBF4):n(H2O)=1:1电解液的曲线下移,电流响应变得更大。
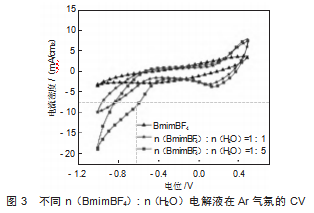
图4展示了不同n(BmimBF4):n(H2O)电解液在CO2气氛下的循环伏安曲线(CV-50 mV/s),其中横坐标为电位(V vs.RHE),纵坐标为电流密度(mA/cm2)。纯BmimBF4电解液在CO2气氛下的电流密度大于在Ar气氛下的电流密度,CO2在该体系下参与了反应。但在整个电位范围内的电流密度相对较低,没有明显的氧化还原峰,仅表现出典型的双电层行为,故其在CO2气氛下的电化学活性较弱,且CO2的溶解度和传质受限。n(BmimBF4):n(H2O)=1:1电解液条件下,相较于Ar,CO2的引入使该体系展现出更明显的法拉第反应,可能是水的存在促进了CO2溶解,提高了反应速率。且相比于纯BmimBF4负电位(<-0.8 V)处电流密度显著增大,表明CO2还原产生了更多的电流。n(BmimBF4):n(H2O)=1:5电解液条件下负电位电流密度进一步增加,达到最高,说明较高的水含量增强了CO2的电化学反应速率,但是需要考虑由于含水量的增加而增强HER影响CO2还原反应的选择性。
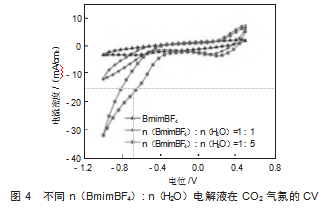
图5展示了不同n(BmimBF4):n(H2O)电解液在CO2气氛下的线性扫描伏安(LSV)曲线,其中横坐标为电位(V vs.RHE),纵坐标为电流密度(mA/cm2)。随着含水量的增加,负电位处的电流密度逐渐增加,同时利用该图计算出了塔菲尔斜率。将LSV曲线中电流密度和电极电位按式(5)进行转换并作图可得到Tafel曲线(见图6)。
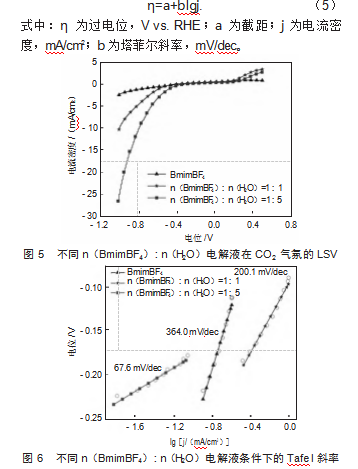
图6展示了不同n(BmimBF4):n(H2O)电解液的Tafel斜率曲线,其中横坐标为对数电流密度lg j,纵坐标为电流密度(mA/cm2)。由于纯BmimBF4粘度较高,离子迁移速率低,导致电荷传递阻力较大。纯BmimBF4电解液的Tafel斜率较大(364.0 mV/dec),电化学反应动力学受限,电子转移过程较慢。n(BmimBF4):n(H2O)=1:1电解液条件下的Tafel斜率降低至200.1 mV/dec,表明水的加入增强了CO2还原的反应动力学。适量的水降低了体系的粘度,提高了离子迁移率,改善了电荷传输过程,使CO2还原反应的速率提高。n(BmimBF4):n(H2O)=1:5电解液条件下的Tafel斜率显著降低至67.6 mV/dec,表明反应动力学进一步提升,CO2还原反应的电子转移过程加快,整体反应阻力减少。
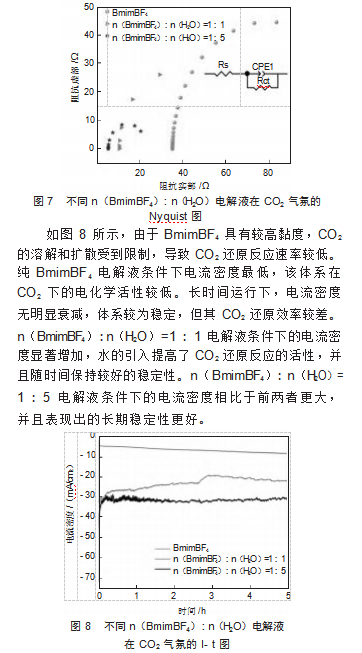
图7展示了不同n(BmimBF4):n(H2O)电解液的电化学阻抗谱图(EIS),其中横坐标为实部阻抗(Z'),纵坐标为负的虚部阻抗(Z'')。EIS图展示了在CO2条件下,不同比例的n(BmimBF4):n(H2O)(纯BmimBF4、1:1和1:5)作为电解液时的阻抗特性。Nyquist图中的半圆形曲线表明电极过程受到电荷转移和电化学反应步骤的共同控制。在纯BmimBF4电解液中,半圆直径最大,表明其电荷转移电阻(Rct)较高,同时溶液电阻(Rs)也较大。BmimBF4的高黏度影响了离子迁移,增加了整体阻抗。n(BmimBF4):n(H2O)=1:1的电解液相比纯BmimBF4电解液,半圆直径减小,起始点更靠近原点,表明Rct降低,同时Rs减少。水的加入改善了离子迁移能力,提高了电解液的导电性。n(BmimBF4):n(H2O)=1:5电解液条件下,Rs及Rct继续降低,溶液的电导率进一步提升。
2.3产物分析
图9展示了不同n(BmimBF4):n(H2O)电解液在CO2RR过程中的法拉第效率(FE)分布,图9中可以得到体系的主要产物为氢气(H2)、一氧化碳(CO)、甲烷(CH4)、甲酸(HCOOH)、甲醇(CH3OH)和乙醇(C2H5OH)。三种不同n(BmimBF4):n(H2O)电解液的H2法拉第效率均较低,低于20%,离子液体电解液体系对HER副反应有明显抑制。CO的法拉第效率在不同摩尔比电解液下均保持较低水平,其作为中间产物并未大量积累,被进一步还原为甲醇、乙醇等还原产物。CH4的法拉第效率在纯BmimBF4电解液中最高,加入H2O后出现降低,CH4的生成在纯BmimBF4的含碳产物中有更高的占比。HCOOH的法拉第效率在所有测试条件下均较高,并且在水含量较高的电解液[n(BmimBF4):n(H2O)为1:1和1:5]中更占主导地位,说明水的加入有利于CO2向甲酸的转化。n(BmimBF4):n(H2O)为1:1和1:5电解液条件CH3OH的法拉第效率相较于纯BmimBF4有所提升,说明水的加入可能优化了CO2还原过程中涉及的电子转移和吸附行为,提高了甲醇的生成选择性。随着电解液中H2O含量的增加,C2H5OH的法拉第效率逐渐增加。H2O作为氢供体,可以提高质子的可用性,使CO2还原更倾向于形成液相产物(CH3OH和C2H5OH)而非气相产物(CH4和CO)。
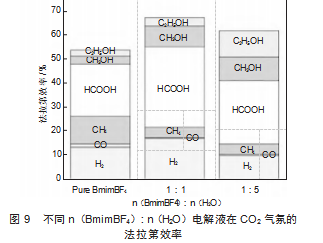
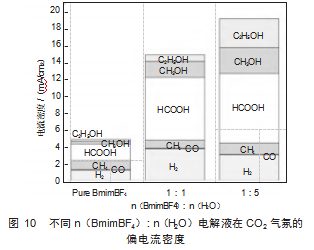
图10展示了不同n(BmimBF4):n(H2O)电解液在CO2RR过程中的偏电流密度变化趋势。随着水含量的增加,总偏电流密度显著提高,这可能是由于水的引入提高了离子迁移率,增强了电解液的导电性。n(BmimBF4):n(H2O)=1:1的电解液相比纯BmimBF4电解液,H2的偏电流密度出现激增。但是n(BmimBF4):n(H2O)=1:5电解液的H2偏电流密度出现减小的趋势。CO的偏电流密度在不同电解液条件下变化不大,说明CO作为中间产物未大量积累。虽然CH4的法拉第效率在纯BmimBF4电解液中最高,但CH4的偏电流密度在不同水含量下波动较小。HCOOH、CH3OH和C2H5OH均表现出随含水量增加而逐渐增大的趋势。水的引入降低了离子液体BmimBF4的黏度,提高了电解质的整体电导率,使离子迁移更加顺畅,从而降低了电极表面的电荷传输阻力,增强了CO2RR的反应速率。水的增加为反应体系提供了更多的质子,促进了CO2还原过程中氢质子参与的质子耦合电子转移(PCET)过程,使得甲酸、甲醇和乙醇等质子参与的还原产物更易生成。而在不同水含量条件下具体的CO2RR机制尚不明确,仍需要探究更细致的n(BmimBF4):n(H2O)电解液的情况。
3结论
本研究通过调控离子液体BmimBF4与水的混合比例,系统研究了其对铜基催化剂电催化CO2还原性能的影响。实验结果表明,适量的水含量能够显著改善电解液的电导率和CO2的溶解度,优化反应动力学,抑制HER,并提升含碳产物的选择性。主要结论如下:
1)电解液比例对反应动力学的影响:随着水含量的增加,电解液的黏度降低,离子迁移率提高,电荷转移阻力减小,反应动力学显著增强。n(BmimBF4):n(H2O)=1:5的电解液体系表现出最低的Tafel斜率和最高的电流密度,其具有最优的反应动力学特性。
2)长期稳定性:n(BmimBF4):n(H2O)=1:5的电解液体系在长时间运行中表现出良好的稳定性,电流密度无明显衰减。
3)产物选择性:水的引入显著提高了甲酸、甲醇和乙醇等含碳产物的法拉第效率,尤其是n(BmimBF4):n(H2O)=1:5的电解液体系提升明显。
本研究通过调控离子液体与水的混合比例,优化了铜基催化剂的CO2还原性能,为开发高效、稳定的CO2RR电解液体系提供了重要的实验依据和理论支持。未来的研究可以进一步探究更细致的不同离子液体与水比例对CO2还原反应机制的影响,以寻找最适合的离子液体电解液体系。
参考文献
[1]朱玲玲,朱伟,贾庆,等.浅谈“双碳”背景下的二氧化碳捕集利用与封存[J]中国水泥,2022(6):17-20.
[2]Zhang F,Gong L,Liu M,et al.Nature of CC coupling and strategy of tuning the catalytic activity of Cu-NC catalysts for electro-reduction of CO2 to ethanol[J].Nano Energy,2024,127:109699.
[3]Cheng Z,Li S,Wang M,et al.Copper overview-from historical aspects to applications:from historical aspects to applications[M].Application of Copper-Based Compounds in Energy Conversion,2024:91.
[4]YesupathamM S,Honnappa B,Agamendran N,et al.Recent develop-ments in copper‐based catalysts for enhanced electrochemical CO2 reduction[J].Advanced Sustainable Systems,2024,8(6):2300549.
[5]Ren X,Wang H,Chen J,et al.Emerging 2D copper‐based materials for energy storage and conversion:a review and perspective[J].Small,2023,19(8):2204121.
[6]Cui X,Wu M,Hou G,et al.Alkali metal ions stabilizing copper(I)sulfur bonds for efficient formate production from electrochemical CO2 reduction[J].ACS Catalysis,2024,14(15):11857-11864.
[7]Fu Z,Zhang J,Wu H,et al.Ionic liquids functionalized copper catalytic systems for electrocatalytic carbon dioxide reduction[J].Chem Cat Chem,2024,16(22):202401049.
[8]Guo S,Liu Y,Wang Y,et al.Interfacial role of Ionic liquids in CO2 electrocatalytic reduction:a mechanistic investigation[J].Chemical Engineering Journal,2023,457:141076.










