Mg- Ce- Ni/Co 多平台储氢合金的制备及其性能的研究论文
2025-10-16 12:05:36 来源: 作者:xuling
摘要:通过球磨技术将Ni、Co粉末与Mg-Ce前驱体复合,成功制备了多平台镁基储氢合金。该多平台镁基储氢合金由主相Mg、催化相Mg2Ni、Mg2Co以及少量Mg12Ce组成,氢化后转化为MgH2-CeH2.73-Mg2NiH4-Mg2CoH5复合材料。
摘要:通过球磨技术将Ni、Co粉末与Mg-Ce前驱体复合,成功制备了多平台镁基储氢合金。该多平台镁基储氢合金由主相Mg、催化相Mg2Ni、Mg2Co以及少量Mg12Ce组成,氢化后转化为MgH2-CeH2.73-Mg2NiH4-Mg2CoH5复合材料。该复合材料具有3个不同高度的PCT平台,分别对应于Mg/MgH2,Mg2Ni/Mg2NiH4和Mg6Co2H 11/Mg2CoH5的可逆脱氢反应。其中,具有高平台压的Mg2Ni/Mg2NiH4反应,促进MgH2的分解并增强放氢动力学性能。具有低平台压Mg6Co2H 11/Mg2CoH5反应,诱导Mg的优先成核并改善了吸氢动力学。这导致该合金具有低的最佳吸氢温度(200℃)和放氢活化能(71.5 kJ/mol)。
关键词:储氢合金;球磨技术;动力学;微观结构
氢能作为一种可再生、零排放、高效率的绿色能源,已经成为全球能源转型的重要选择。然而,从氢能综合应用的角度出发,安全高效的氢储存与运输依然是制约氢能规模化利用的关键技术[1]。因为传统的高压气态储氢和低温液态储氢,到目前为止,依然无法避免其存在安全隐患。相比较而言,固态储氢便成为了更有价值的选择。在众多的固态储氢材料体系中,仅有镁基合金具有高的储氢容量(MgH2质量分数约7.6%)[2]。此外,镁资源丰富,环境友好,且具有优异的可逆性。因此,镁基合金成为最有发展前景的固态储氢材料。然而,Mg-H键非常稳定,这导致其需要非常高的温度才能使其断裂并放出氢气。此外,Mg金属易于氧化、表面氢解离能低等问题,均从不同程度上导致其动力学性能缓慢,无法满足实际应用的需求。
一般来说,合金化被认为是改善Mg基材料储氢性能的最基本方法,通过该方法可以从根本上加速动力学并降低热力学稳定性。这主要是因为合金化引入的更有效的原位催化作用。欧阳等[3]通过合金化制备了Mg80Ce18Ni2和Mg12YNi合金。加氢后,原位形成的稀土氢化物,即CeH2.73和YH3,大大提高了镁基材料的热力学和动力学性能。此外,合金化还可以引入多相协同效应,即两个或多个相之间的协同促进作用。Mg-Mg2Ni储氢体系即是一个典型的例证[4]。加氢后,原位形成Mg2NiH4,与MgH2相比可以优先释放氢气,导致晶格收缩,增加界面间隙,并进一步诱导了MgH2的分解阶段。由于MgH2和Mg2NiH4相之间的协同作用,Mg-Mg2Ni的氢解吸速率大大加快。同时,Zepon等[5]报道了MgH2-Mg2CoH5系统的储氢性能,并发现Mg2CoH5的复合氢化物在分解过程中产生一个中间产物,即Mg6Co2H11氢化物。此外,MgH2-Co复合粉末[6]
的氢化PCI特征也显示,其具有额外的两个停滞期,对应于Mg6Co2H11和Mg2CoH5氢化物相的形成,并且在氢吸收和解吸过程中,这些氢化物与MgH2之间也存在互助关系。人们普遍认为,低平台压力的合金在相同的外部压力下具有更高的氢吸收驱动力,这对于氢吸收动力学是有利的。因此,预计Mg2NiH4和Mg2CoH5的协同作用可以双重增强Mg基储氢材料的吸氢和解吸动力学。在此基础上,以前期研究Mg-Ce合金[7]为基础,成功制备了具有多平台的镁基Mg-Ce-Ni/Co储氢合金,并评估Ni,Co化合物相在其中的催化机制。
1研究方法
1.1样品准备
将制备的Mg-Ce合金铸锭机械粉碎成200目(0.075 mm)以下的粉末,并按比例混合Ni和Co粉。在0.2 MPa的高纯度氩气气氛中,使用行星式球磨机(QM-3SP2)对由其混合粉末进行球磨。其中,球料质量比为40∶1,转速为350 r/min,球磨时间为5 h,且每连续研磨30 min后中断10 min,以防止过热。同时,使用质量分数1.0%的硬脂酸作为控制剂,以避免镁颗粒的聚集。所得粉末混合物取200目(0.075 mm)以下作为后续实验的样品,并命名为Mg-Ce-Ni-Co样品。应注意的是,所有粉末样品都在装有高纯度氩气的手套箱中处理,以避免氧化和燃烧。
1.2性能测试
为保证采用D/max 2550VL/PC型X射线衍射仪测试分析样品在不同状态下的物相组成,其中扫描速度10(°)/min,扫描范围为10°~90°。样品的吸放氢等温动力学曲线,使用PCT是用BSD-PH型全自动高温高压气体吸附仪进行测试。在进行测试前,样品合金首先要在360℃,压力为3 MPa条件下活化6次。然后分别测试其在不同温度下的PCT平台压,以及等温吸氢动力学曲线和等温放氢动力学曲线。此外,采用差示扫描量热法进行了脱氢性能分析,氩气流速为100 mL/min。
2结果与讨论
2.1微观结构
图1为球磨态、氢化态和脱氢态的Mg-Ce-Ni/Co粉末样品的XRD图谱。从图1(a)可以看出,球磨样品由Mg12Ce、Mg及Mg2Ni和Mg2Co组成。如图1(b)所示,氢化之后,球磨样品中的衍射峰全部消失,并被各自相应的氢化物所取代,包括MgH2、CeH2.73相以及预期的Mg2NiH4和Mg2CoH5相。到目前为止,已通过机械球磨结合随后的氢化反应成功制备了含Mg2NiH4和Mg2CoH5的镁基复合材料。然而,在放氢之后,MgH2和Mg2NiH4转化为Mg和Mg2Ni相,CeH2.73相稳定存在,Mg2CoH5消失,并出现了单值Co和Mg6Co2H11相。由此,可以推断Mg-Ce-Ni/Co粉末样品的可逆氢化过程包含式(1)—式(3)反应:
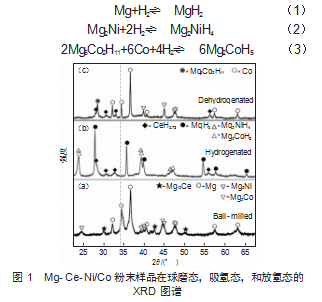
2.2热力学性能
图2为样品在不同温度下的PCT曲线,显然,每条曲线中,都包含3个不同高度的平台。中间宽而平的平台对应于Mg和MgH2之间的可逆反应[式(1)],这是一个主要的可逆反应。相比之下,其他两个滞后较大的平台分别对应于Mg2Ni/Mg2NiH4[式(2)]和Mg6Co2H11/Mg2CoH5[式(3)]的可逆反应。这与XRD分析一致,不同的可逆过程,分别对应于不同高度的平台。表1列出了不同温度下PCI曲线测量的平衡压力。根据平衡压力,样品加氢和脱氢的焓变(ΔH)和熵变(ΔS)可以根据范霍夫公式[式(1)][8]计算:
ln(pH2/p0)=ΔH/RT-ΔS/R.(1)
所得结果也列于表1中。从表1中可以看出Mg2Ni/Mg2NiH4和Mg6Co2H11/Mg2CoH5的ΔH值小于Mg/MgH2,表明在满足Mg/MgH2可逆反应的前提下,Mg2Ni/Mg2NiH4和Mg6Co2H11/Mg2CoH5的可逆反应不受热力学条件的限制,这为双平台共催化奠定了热力学基础。
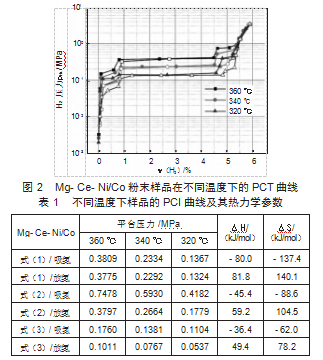
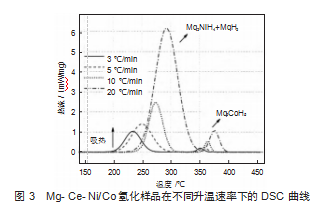
通过DSC热分析,对氢化样品的脱氢行为进行了评估。如图3所示。每条曲线中都有2个吸热峰,对应于氢化物的分解反应。根据XRD图谱分析,氢化样品中存在3种可分解的氢化物(MgH2、Mg2NiH4和Mg2CoH5)。然而,每条DSC曲线上只有2个吸热峰,这表明2种氢化物的分解过程完全重叠。大量实验表明[9-10],在Mg-Mg2NiH4体系的脱氢过程中,MgH2和Mg2NiH4存在协同作用,其中具有高的平台的Mg2NiH4,优先分解释放氢原子,然后与MgH2周围的氢原子结合成氢分子并释放到合金粒子的外部,以至于减少MgH2周围氢原子的浓度,进而促进了MgH2的分解。因此,在DSC脱氢分析中,其放热峰呈现了完全重叠现象。此外,Mg2CoH5放氢平台压要比MgH2相低,所以其未能优先释放氢气,也未对MgH2的分解产生促进作用。因此,低温区的吸热峰对应MgH2与Mg2NiH4的协同分解反应,高温区的吸热峰则对应Mg2CoH5的分解反应。这里值的一提的是,具有低平台压的Mg2CoH5将会优先MgH2吸氢,并进一步促进MgH2吸氢反应进行。
2.3动力学性能
图4-1显示了活化的Mg-Ce-Ni/Co样品在3.0 MPa的初始氢压下在各种温度下的氢吸收动力学曲线。从中可以发现,当温度大于200℃时,曲线形状几乎相同。然而,随着反应温度的进一步降低,吸收动力学也显著降低。具体地,在150℃下,样品可以在1 min内吸收超过质量分数5.0%的氢,但是在50℃和100℃的温度下,即使在30 min后,氢吸收容量也仅为质量分数1.5%和4.0%。即便如此,它仍然比其他Mg-Ce-Ni合金更快[11]。这体现出其优异的低温吸氢能力,主要归因于Mg6Co2H11相低的吸氢平台压。平台压越低,相同氢压下的吸氢驱动力越大,故Mg6Co2H11相优先镁相吸氢,并进一步驱动Mg相吸氢。图4-2显示了活化Mg-Ce-Ni/Co样品在150℃以上1 min内的吸氢动力学曲线,从中我们可以发现,除150℃外,不同温度下的样品在1 min内达到质量分数5.5%吸氢容量。可见,低温不利于氢的吸收。这是因为通过氢化物层的氢扩散步骤是一个温度控制的扩散步骤,高温更容易克服其扩散能垒。然而,随着温度的升高,氢吸收速率先增加,然后减小,其中最佳氢吸收动力学出现在200℃。这是因为氢的吸收过程是放热的,因此温度的降低可以促进加氢反应。这两个相反的因素决定了在吸氢过程中存在一个“最佳氢化温度”,这个温度可以定性地代表样品的吸氢活化能,即最佳氢化温度越低,吸收活化能越低。
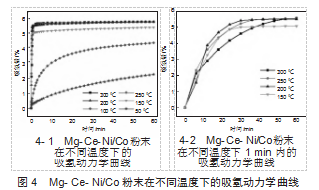
图5-1显示了活化的Mg-Ce-Ni/Co样品在0.005 MPa初始氢压、不同温度下的脱氢动力学曲线。与吸氢动力学不同,吸氢动力学随温度的下降而下降,这主要是由于脱氢是吸热反应,温度的增加有利于其氢化物的形核过程。从图5-1中可以看出,完全氢化后的样品在360℃下4 min内和340℃下7 min内可以解吸质量分数5.6%的氢气,等于其最大吸氢容量(图4-1),这表明Mg-Ce-Ni-Co合金具有出色的可逆性能。此外,随着温度的降低,样品仍然具有非常快的脱氢动力学,样品的实施也可以分别在320℃下8 min、300℃下17 min内实现完全脱氢。然而当温度低于340℃,样品只能释放质量分数5%的H2。这主要是由于Mg2CoH5相在当前温度下不会分解,这与PCT和DSC析非常吻合。因此,就样品的氢释放而言,Mg2NiH4相的分解在催化中起主导作用,而形成的Mg2CoH5相仅在吸氢过程中起主要催化作用。
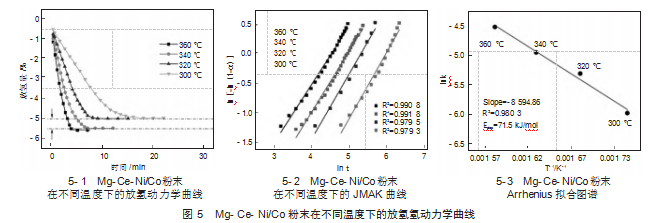
通常,JMAK方程可以确定氢解吸过程的固态反应机理。因此,JMAK公式[12]可用于根据图5-1中的放氢曲线进一步证明样品的脱氢动力学行为,内容如公式(2)所示:
ln[-ln(1-α)]=ηln k+ηln t.(2)式中:α为反应分数;t为反应时间;k为速率常数;η为Avrami指数。
建立了300~360℃范围内的ln[-ln(1-α)]与ln t的拟合曲线,如图5-2所示。根据上述相关线性曲线的截距和斜率,可以准确地获得ln k值。故此,脱氢活化能(Ea)也可以通过Arrhenius公式(3)[13]获得:
ln k=-(Ea/R)(1/T)+lnA.(3)式中:R为气体常数,8.314 J/(mol·K);T为绝对温度;A为频率因子。
图5-3为根据式(3)绘制的Arrhenius图谱,并通ln k对1/T图的线性斜率可以计算出氢解吸活化能(Ea)。其中,Ea的值为71.5 kJ/mol,且远低于Mg-Ce合金[7]的值。这表明Ni的添加显著改善了合金的生成动力学,主要归因于原位形成的Mg2Ni/Mg2NiH4是改善镁基合金脱氢过程的高效催化剂。同样,原位形成的Mg6Co2H11/Mg2CoH5也是改善镁基合金加氢过程的高效催化剂,由于它能有效降低氢化能垒,所以能在较低的温度下达到最佳的氢吸收率。
3结论
通过球磨合成Mg-Ce-Ni/Co储氢合金粉末,并通过氢化反应,转化为MgH2-CeH2.73-Mg2NiH4-Mg2CoH5复合材料,然而,在氢解吸后,Mg2CoH5相没有像预期的那样分解为Mg2Co相,而是分解为伴随元素Co相的Mg6Co2H11相。活化的Mg-Re-Ni-Co合金具有3个不同高度的PCI平台,分别对应于Mg6Co2H11/Mg2CoH5,Mg/MgH2和Mg2Ni/Mg2NiH4的可逆吸氢和解吸反应。其中,高平台压的Mg2Ni/Mg2NiH4反应,促进MgH2的分解并增强放氢动力学性能。同时,低平台压Mg6Co2H11/Mg2CoH5反应,诱导Mg的优先成核并改善了吸氢动力学。在此双平台的作用下,该合金的最佳吸氢温度为200℃,且在低温下具有优异的氢吸收性能,在100℃的温度下,可以在10 min内吸收质量分数3.0%的H2,在30 min内吸收4.0%的H2。此外,其脱氢活化能的计算值为71.5 kJ/mol,远低于Mg及Mg-Ce合金放氢活化能。
参考文献
[1]葛书强,杨中桂,白洁,等.可再生能源制氢技术及其主要设备发展现状及展望[J].太原理工大学学报,2024,55(5):759-787.
[2]兰勇,张羊换,孙涵丰,等.(LaCa3)0.5-xMg1+4xNi9(x=0,0.02,0.04,0.06,0.08,0.1)合金微观结构及储氢性能研究[J].内蒙古科技大学学报,2023,42(3):238-242.
[3]Ouyang LZ,Liu F,Wang H,et al.Magnesium-based hydrogen storage compounds:a review[J].J Alloys Compounds,2020,832:154865.
[4]Cermak J,David B.Catalytic effect of Ni,Mg2Ni and Mg2NiH4 upon hydrogen desorption from MgH2[J].Int J Hydrogen Energy,2011,36:13614-13620.
[5]Zepon G,Leiva DR,Strozi RB,et al.Structural characterization and hydrogen storage properties of MgH2-Mg2CoH5 nanocomposites[J].Int J Hydrogen Energy,2017,42:14593-14601.
[6]Khan D,Zou JX,Pan MG,et al.Hydrogen storage properties of nanos-tructured 2MgH2-Co powders:the effect of high-pressure compression[J].Int J Hydrogen Energy,2019,44:15146-15158.
[7]Yong H,Guo SH,Yuan ZM,et al.Phase transformation,thermody-namics and kinetics property of Mg90Ce5RE5(RE=La,Ce,Nd)hydro-gen storage alloys[J].Journal of Materials Science&Technology,2020,51:84-93.
[8]Liu ZC,Li YM,Ruan F,et al.Enthalpy analysis ofCe-Mg-Ni-H for-mation based on extended miedema theory:investigation of selected Ce2MgNi2-H2[J].Int J Hydrogen Energy,2021,46:4201-4210.
[9]Yang T,Wang P,LiQ,et al.Hydrogen absorption and desorption be-havior of Ni catalyzed Mg-Y-C-Ninanocomposites[J].Energy,2018,165:70919.
[10]Li YZ,Yang J,Luo L,et al.Microstructure characteristics,hydrogen storage kinetic and thermodynamic properties of Mg80-xNi20Yx(x=0-7)alloys[J].Int J Hydrogen Energy,2019,44:7371-7380.
[11]Yong H,Guo SH,Yuan ZM,et al.Catalytic effect of in situ formed Mg2Ni and REHx(RE:Ce and Y)on thermodynamics and kinetics of Mg-RE-Ni hydrogen storage alloy[J].Renew Energy,2020,157:828-839.
[12]Wang F,Li RF,Ding CP,et al.Effect of catalytic Ni coating with dif-ferent depositing time on the hydrogen storage properties of ZrCoal-loy[J].Int J Hydrogen Energy,2016,41:17421-17432.
[13]Fu YK,Ding ZM,Ren SQ,et al.Effect of in-situ formed Mg2Ni/Mg2NiH4 compounds on hydrogen storage performance of MgH2[J].Int J Hydrogen Energy,2020,45:28154-28162.










