卢非酰胺的合成工艺改进研究论文
2024-12-10 11:16:24 来源: 作者:liziwei
摘要:本文对抗癫痫药物卢非酰胺合成工艺进行了改进。以叠氮磷酸二苯酯(DPPA)作为叠氮化试剂,与2,6-二氟苄溴反应得到1-叠氮甲基-2,6-二氟苯,再与丙炔酸甲酯Click环合反应得1-[(2,6-二氟苯基)甲基]-1H-1,2,3-三唑-4-甲酸甲酯,最后氨解得到抗癫痫药物卢非酰胺,总收率约63%。本文发展的方法避免了叠氮化钠的直接使用,以水作为反应媒介,具有良好的工业应用前景。
摘要:本文对抗癫痫药物卢非酰胺合成工艺进行了改进。以叠氮磷酸二苯酯(DPPA)作为叠氮化试剂,与2,6-二氟苄溴反应得到1-叠氮甲基-2,6-二氟苯,再与丙炔酸甲酯Click环合反应得1-[(2,6-二氟苯基)甲基]-1H-1,2,3-三唑-4-甲酸甲酯,最后氨解得到抗癫痫药物卢非酰胺,总收率约63%。本文发展的方法避免了叠氮化钠的直接使用,以水作为反应媒介,具有良好的工业应用前景。
关键词:卢非酰胺;叠氮化;抗癫痫药物;合成工艺
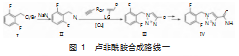
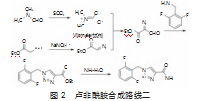
卢非酰胺(rufinamide,Ⅳ),化学名称为1-[(2,6-二氟苯基)甲基]-1H-1,2,3-三唑-4-甲酰胺,是瑞士诺华制药公司开发的一种钠离子通道活性调节剂,被用于辅助治疗局部癫痫发作和Lennox-Gastaut综合征(LGS)的辅助治疗,于2007年在欧盟获批上市。研究表明该药物耐受性良好、安全性高。根据文献报道,卢非酰胺Ⅳ的合成路线可以归纳为两种:路线一(图1)以2,6-二氟苄基叠氮化物(Ⅱ)为关键中间体构建1,2,3-三氮唑结构(Ⅲ)。首先以叠氮化钠为叠氮试剂与2,6-二氟苄氯/溴进行叠氮化反应得到2,6-二氟苄基叠氮化物(Ⅱ),随后2,6-二氟苄基叠氮化物(Ⅱ)与端炔(丙炔酸衍生物)或端炔的前体(如2-氯丙烯腈、2-溴丙烯酸酯和1-甲氧基丙烯酸酯)在铜催化剂或有机溶剂的存在下发生环化反应构建1,2,3-三氮唑结构,最后通过官能团的修饰得到卢非酰胺。路线二[5](图2)以N,N-二甲基甲酰胺和甘氨酸乙酯盐酸盐为起使原料的合成方法。首先DMF与氯化亚砜反应生成Vilsmeier中间体,然后与甘氨酸乙酯盐酸盐重氮化物发生甲酰化,最后与苄胺环合及酰胺化得目标化合物Ⅳ。
上述工艺主要存在以下不足:一是路线一制备中间体Ⅱ,使用了叠氮化钠作为叠氮化试剂。叠氮化钠是一种高危试剂,不仅高毒且受热、接触明火、受到摩擦、震动、撞击时可发生爆炸;二是路线一制备中间体Ⅲ时,使用了铜催化剂,本品为三氮唑化合物且性质难溶,容易与铜盐催化络合,导致产品颜色较深和铜催化剂残留超标,难以通过简洁的纯化工艺获得符合要求的产品;三是路线二涉及了性质不稳定的Vilsmeier试剂和重氮物中间体的制备,中间体稳定性较差,总收率仅为10%。
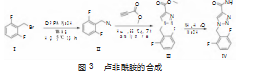
本文基于路线一进行了工艺改进(图3),以叠氮磷酸二苯酯(DPPA)为叠氮化试剂与2,6-二氟苄溴反应得到中间体Ⅱ,然后与丙炔酸甲酯在无催化的条件下环合反应得到化合Ⅲ,最后氨解得到卢非酰胺Ⅳ。本文的卢非酰胺改进工艺避免了高危叠氮化钠的直接使用,以水作为环合步骤反应溶剂,具有无金属催化剂使用、无需柱层析纯化、操作简单、产品纯度高和成本低的特点,适合工业应用。
1实验部分
1.1 2-叠氮甲基-1,3-二氟苯(Ⅱ)的合成
向500 mL反应瓶中依次加入水(200mL)、氢氧化钠(40.0 g,1 000 mmol)、叠氮磷酸二苯酯(30.3 g,110 mmol)、2,6-二氟苯苄溴(20.7 g,100 mmol),启动搅拌,加入四丁基溴化铵(16.1 g,50 mmol)。将反应体系温度升至50℃,保温反应4 h,TLC监测反应结束。将反应冷却至室温,用石油醚(100 mL×3)萃取反应液3次,然后用纯化水洗涤(100 mL×2)有机相2次。收集有机相并用10 g无水硫酸脱水4 h。过滤除去硫酸钠,滤液减压浓缩得到15.1 g油状物,未进一步纯化用于下步反应(HPLC归一化法化学纯度97%以上,产率89.3%)。1H NMR(400 MHz,CDCl3)δ7.43 7.21(m,1H),6.99~6.78(m,2H),4.42(s,2H);13C NMR(100 MHz,CDCl3)δ161.5(d,J=250.3Hz,2C),130.6(t,J=10.3Hz,1C),113.7~110.0(m,3C),41.8(t,J=3.0 Hz,1C)。
1.2 1-(2,6-二氟苄基)-1H-1,2,3-三氮唑-4-甲酸甲酯(Ⅲ)的合成
向250 mL反应瓶中加入纯化水(100 mL)、化合物Ⅱ(10.0 g,59.1 mmol)、丙炔酸甲酯(5 9 g,70.9 mmol),启动搅拌。将体系温度升高至60℃并保持6 h。TLC监测反应,化合物Ⅱ消失,停止加热。反应液温度冷却至室温,抽滤。用95%的乙醇(100 mL)淋洗滤饼,滤饼在60℃鼓风干燥3 h。称重得白色晶性粉末12.3 g,收率为82.0%。1H NMR(400 MHz,DMSO)δ8.88(s,1H),7.76~7.40(m,1H),7.31~7.04(m,2H),5.78(s,2H),3.86(s,3H);13C NMR(100 MHz,DMSO)δ161.3(d,J=249.6Hz,2C),161.0(s,1C),139.0(s,1C),132.3(t,J=10.4 Hz,1C),129.9(s,1C),112.4(d,J=24.4 Hz,1C),112.4(d,J=13.2 Hz,1C),111.30(t,J=18.9 Hz,1C),52.2(s,1C),41.8(s,1C)。
1.3卢非酰胺(Ⅳ)的合成
向500 mL的三口瓶加入水(180 mL)、化合物Ⅲ(10.0 g,39.5 mmol),加热至60℃,缓慢加入28%的氨水(96.1 g,1.58 mol),随后保温65℃反应10 h。TLC监测反应完全。冷却至室温,抽虑,滤饼用100 mL甲醇淋洗。收集滤饼,干燥后得到8.1g白色晶体粉末,收率为86.2%。ESI-HRMS(m/z):239.0739[M+H]+;1H NMR(400 MHz,DMSO)δ8.56(s,1H),7.86(s,1H),7.59~7.44(m,2H),7.20(dd,J=9.6,6.6 Hz,2H),5.73(s,2H);13C NMR(100 MHz,DMSO)δ161.7(s,1C),161.2(d,J=249.4Hz,2C),143.3(s,1C),132.3(t,J=10.4 Hz,1C),127.2(s,1C),112.7~112.0(m,2C),111.5(t,J=19.1 Hz,1C),41.6(s,1C)。
2结果与讨论
2.1 2-叠氮甲基-1,3-二氟苯(Ⅱ)的合成
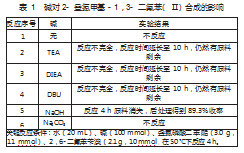
在化合物Ⅱ的合成中,碱对叠氮化反应的促进作用是至关重要的。作者分别对无碱、三乙胺(TEA)、二异丙基乙胺(DIEA)、1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)、氢氧化钠、碳酸酸钠进行了研究。实验结果显示(如表1所示),在反应4 h后,氢氧化钠的促进效果最好(TLC显示原料消失),在添加机碱(TEA、DIEA、DBU)的实验中有大量的原料剩余,在无碱和碳酸钠的实验中则没有目标产物生成。需要注意的是当原料不能反应完全,剩余的原料很难通过简单的工艺将其去除(反应2~4),而当反应原料彻底转化时只需要通过简单萃取操作就可以得到化学纯度97%以上的产品(反应5)。
2.2 1-(2,6-二氟苄基)-1H-1,2,3-三氮唑-4-甲酸甲酯(Ⅲ)的合成
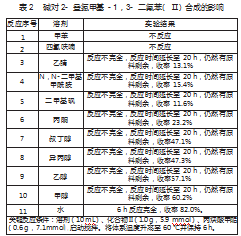
在化合物Ⅲ的合成中,溶剂对1,2,3-三氮唑的构建具有很大的影响。作者分别对非质子溶剂(甲苯、四氢呋喃、乙腈、N,N-二甲基甲酰胺、二甲基砜及丙酮)合质子溶剂(叔丁醇、异丙醇、乙醇、甲醇及水)对反应的影响进行了研究(如表2所示)。在非质子溶剂的研究实验中(反应1~6)没有得到理想的结果:反应20 h,仍然有大量的原料剩余,其中,在甲苯和四氢呋喃作为反应溶剂的实验中没有观察到目标产物生成、在乙腈、N,N-二甲基甲酰胺、二甲基砜和丙酮作为反应溶剂的实验中获得目标物产率11.6%~23.2%。在质子溶剂的研究实验中(反应7~11)实验结果比非质子溶剂好一些(目标物的产率为47.1%~82.0%),其中在水作为反应溶剂的实验中(反应11)呈现出最好的结果(获得目标物产率为82.0%)。
2.3卢非酰胺(Ⅳ)的合成
从化合物III到卢非酰胺(Ⅳ)的合成未为酯的氨解反应,本文尝试了氨水、乙醇-氨水混合、N,N-二甲基甲酰胺-氨水混合等条件,最终确定了水-氨水混合为最优的氨解反应条件,在此条件下产率大于86.2%,化学纯度达到了98%。
3结论
本文对抗癫痫药物卢非酰胺合成工艺进行了改进,并对其关键工艺参数进行了优化。以叠氮磷酸二苯酯(DPPA)作为叠氮化试剂,与2,6-二氟苄溴反应得到1-叠氮甲基-2,6-二氟苯,再与丙炔酸甲酯Click环合反应得1-[(2,6-二氟苯基)甲基]-1H-1,2,3-三唑-4-甲酸甲酯,最后氨解得到抗癫痫药物卢非酰胺,避免了叠氮化钠的直接使用,以水作为反应媒介,具有良好的工业应用前景。
参考文献:
[1]R.Meier,Aralkyltriazole Compounds:EP0114347A3[P].1988-01-29.
[2]Selim A,Neethu K M,Gowri V,et al.Thiol Functionalized cellulose wrapped copperoxide as a green nano catalyst for regiospecific azide alkyne cycloaddition reaction:application in rufinamide synthesis[J].Asian Journal of Organic Chemistry,2021,10:3428-3433.
[3]Padmaja R.D.,Chanda K.,A short review on synthetic advances to-ward the synthesis of rufinamide,an antiepileptic drug[J].Organic Process Research&Development,2018,22:457-466.
[4]Meena D.R.,Rao R.N.,Maiti B.,et al.Novel Cu(I)-catalyzed one-pot multicomponent synthesis of the antiepileptic drug rufinamide[J].Research on Chemical Intermediates,2017,43:4711-4717.
[5]王兴勇,杨志林,抗卢非酰胺(Rufinamide)合成新工艺[J].应用化学,2009(26):353-357.










