基于ROS风暴策略的仿生MOF递药系统用于乳腺癌高效铁死亡治疗论文
2024-11-13 14:34:55 来源: 作者:liziwei
摘要:目的:采用化学法合成了一种金属有机框架载体材料,并探索用于乳腺癌高效铁死亡治疗。方法:采用溶剂热合成了一种多孔铁基金属有机框架(Fe-MOF)载体,通过非溶剂法负载双氢青蒿素(DA),并以癌细胞膜进行表面修饰来构建仿生MOF递药系统(R Fe-DA MOFs),并对其形貌、载药量、抗癌活性、抗癌机制等进行系统评价。结果:R Fe-DA MOFs粒径均一,载药量较大,体外抑瘤效果好,细胞ROS含量高,细胞摄取理想,时间越长,摄取越充分。R Fe-DA MOFs的体内效果最强,且生物安全性良好。结论:R Fe
摘要:目的:采用化学法合成了一种金属有机框架载体材料,并探索用于乳腺癌高效铁死亡治疗。方法:采用溶剂热合成了一种多孔铁基金属有机框架(Fe-MOF)载体,通过非溶剂法负载双氢青蒿素(DA),并以癌细胞膜进行表面修饰来构建仿生MOF递药系统(R Fe-DA MOFs),并对其形貌、载药量、抗癌活性、抗癌机制等进行系统评价。结果:R Fe-DA MOFs粒径均一,载药量较大,体外抑瘤效果好,细胞ROS含量高,细胞摄取理想,时间越长,摄取越充分。R Fe-DA MOFs的体内效果最强,且生物安全性良好。结论:R Fe-DA MOFs是一种潜在的优异递药系统,对于双氢青蒿素的临床开发具有重要的价值。
关键词:ROS;双氢青蒿素;铁基有机框架;乳腺癌
迄今为止,乳腺癌的发病率已跃升至所有癌症的首位,乳腺癌已成为全球妇女癌症死亡的主要诱因。因此仍是临床上的一个公开挑战。双氢青蒿素(Dihydroartemisinin,DA)可以通过Fe2+所介导细胞氧化损伤,促进活性氧(ROS)的产生,从而打破乳腺癌细胞的氧化和抗氧化平衡,引发肿瘤铁死亡。铁死亡疗法(Ferroptosis Therapy,FT)是一种与DA相似但不同的肿瘤治疗方法,它利用包括芬顿反应在内的一切方法产生活性氧(ROS)。因此,DA也是一种FT。其抗肿瘤效果和Fe2+有着密切的联系,Fe2+可以还原其内部的过氧桥键,键的断裂会释放有毒自由基,其中就包含ROS,过量的ROS推动脂质过氧化引起肿瘤细胞铁死亡。DA诱导的铁死亡与肿瘤细胞微环境内的Fe2+浓度间存在着正比关系。微环境所含Fe2+浓度越高,其铁死亡效果越明显。但正常人体细胞内,不稳定铁池(LIP)和铁蛋白的存在,使得细胞能够持续且稳定地储存和调控Fe2+,始终维持在一定稳定水平内。因此,单纯依靠肿瘤细胞所含的Fe2+浓度,显然是不足的,DA的铁死亡效果维持在较低的水平内。所以从外部获取更多的Fe2+就显得极其重要。一旦肿瘤微环境的的Fe2+浓度超标,体内Fe2+平衡失调、代谢紊乱,诱导发生芬顿反应,即过量的Fe2+反应形成羟自由基,促进脂质ROS的形成,使细胞发生铁死亡。
近来,ROS风暴策略在肿瘤治疗领域得到密切关注。Shen等提出了一种产生ROS风暴的策略,并成功应用于肿瘤高效铁死亡。ROS风暴以产生过量ROS为目的,以细胞铁死亡为基础。通过设计多重ROS释放途径,如芬顿反应和GSH。协同促进细胞内氧化应激水平,实现铁死亡。因此,ROS风暴是一种治疗新颖、富有前途的肿瘤细胞铁死亡诱导方案。基于ROS风暴策略,本文基于前期MOF研究基础上,设计了一种新型仿生MOF递药系统(R Fe-DA MOFs新型递药系统,图1),可产生ROS风暴抑瘤环境,通过铁死亡促癌细胞死亡。主要机制:一是利用癌胞膜伪装递送载体,抑制免疫细胞吞噬,实现血液长循环,将所包覆载体Fe-DA MOFs特异性地同源靶向递送至靶癌细胞。二是Fe-DA MOFs裂解释放的Fe2+显著提高肿瘤内环境的Fe2+浓度,高浓度Fe2+和H2O2之间的芬顿反应可产生ROS,诱导铁死亡。三是大量的DA过氧桥键在Fe-MOFs提供的高浓度Fe2+的催化下断裂释放有毒自由基即ROS,进一步提高细胞氧化应激水平,刺激乳腺癌细胞铁死亡。上述双重、协同促ROS过程,在癌细胞内刺激产生ROS风暴,促进乳腺癌细胞铁死亡。
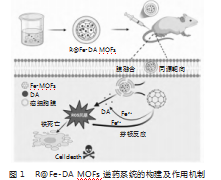
1材料和方法
1.1主要材料与仪器
双氢青蒿素,上海麦克林生化科技有限公司;NH2-BDC,上海麦克林生化科技有限公司;DMF,上海麦克林生化科技有限公司;FeCl2·4H2O,上海麦克林生化科技有限公司;PBS,中国医药集团有限公司;二甲基亚砜,上海麦克林生化科技有限公司;水为去离子水。
UV-1200型紫外可见分光光度计,美国尤尼柯公司;FA2004型电子天平,上海良平仪器仪表有限公司;pHS-3C型pH计,上海仪电科学仪器股份有限公司;TDL-80-2B型离心机,上海安亭科学仪器厂;KQ-500DB型数控超声仪,昆山市超声仪器有限公司;JEM-F200型透射电子显微镜,日本电子株式会社。
1.2 R Fe-DA MOFs的合成
采用溶剂热合成法制备Fe-MOFs,选用四水合氯化亚铁(FeCl2·4H2O)作为铁源,氨基对苯二甲酸(NH2-BDC)为有机配体,甲醇和N,N-二甲基甲酰胺(DMF)为溶剂,在氢氟酸条件下,减少副产物的出现。具体方法如下:取1.12g FeCl2·4H2O和0.5 g NH2-BDC溶于含有100 mL DMF的三颈烧瓶中,再依次加入10 mL甲醇和3 mL的氢氟酸。通入氮气,搅拌加热24 h。冷却至室温,再次使用甲醇和DMF冲洗,晾干。即得到所需Fe-MOFs。
取上述制备的干燥Fe-MOFs粉末适量溶于20 mL乙醇中。称取适量双氢青蒿素一并加入。在室温下密封恒温搅拌一段时间,使充分混合。再将混合溶液于旋蒸仪上旋蒸至无溶液,用乙醇冲洗几次,离心,得到产物Fe-DA MOFs。然后再通过超声降解法将经超声处理纯化的细胞膜包裹至Fe-DA MOFs,得到R Fe-DA MOFs。
1.3 R Fe-DA MOFs的形态表征
称取适量R Fe-DA MOFs,溶于去离子水中,利用激光粒度仪考察其粒径分布和大小。并通过透射电子显微镜观察其外观形态。
1.4 R Fe-DA MOFs含药量的测定
称取适量制备的R Fe-DA MOFs,溶于1 mol/L HCl中,降低pH,剧烈搅拌使包封的DA从R Fe-DA MOFs中释放出来,反应液15 000 r/min离心10 min后取上清定量,带入DA标曲计算含药量。
1.5 R Fe-DA MOFs的体外抗癌评价(MTT)
使用小鼠乳腺癌细胞(4T1)评价R Fe-DA MOFs的体外抗癌效果。配制5 mg/mL质量浓度的MTT溶液,备用。将4T1细胞接种到96孔板的细胞培养板中。在37℃下培育24 h,诱导贴壁。然后,分别稀释DA、Fe-DA MOFs和R Fe-DA MOFs至不同浓度。每个浓度分别滴加3个孔,每孔滴加量相同。继续在培养箱中培养24 h。然后采用MTT检测法测量各孔细胞活力。
1.6细胞内ROS含量测定
如前文所述,R Fe-DA MOFs的抗癌机理与ROS具有密切的联系,高ROS含量最终可以诱导铁死亡,达到抗癌效果。为此计划通过DCFH-DA试剂盒检测4T1细胞在被R Fe-DA MOFs处理过后细胞中的ROS水平。具体方法如下:将4T1细胞接种在六孔板中(1×105细胞/孔),恒温37℃培养24 h使细胞贴壁。其后,将培养的细胞与DA、Fe-DA MOFs和R Fe-DA MOFs继续共同培养24h,三者含有相同浓度的DA(20μg/mL)。培养结束后,用PBS洗涤细胞两次,待DCFH-DA染色完毕,再在37℃的条件下反应30 min。最终,再利用PBS洗涤残留DCFH-DA,并通过倒置荧光显微镜观察和记录细胞内的荧光情况。
1.7 R Fe-DA MOFs的细胞摄取
将处于对数生长期的4T1肿瘤细胞接种在12孔板中,每孔2×104个细胞,培养24 h(37℃、5%CO2)使其贴壁。稀释R Fe-DA MOFs,使其质量浓度为2 mg/mL。分别向12孔板中加入1 mLR Fe-DAMOFs,在细胞培养箱中继续分别培育1、2、4 h后取出,将细胞用PBS洗涤3次。再加入4%多聚甲醛以固定,最后用倒置荧光显微镜观察荧光所成像,并测定荧光强度。
1.8 R Fe-DA MOFs的体内抗癌评价
取18~23 g的雌性小鼠,植入4T1细胞,建立小鼠乳腺癌模型。一段适应期后,给小鼠服用R Fe-DA MOFs一周,每日剂量为50 mg/kg,每隔一天记录一次称重,同时记录死亡和进食量等。此外,还需计算肿瘤体积,也为隔天计算一次。第8天处死各组老鼠。解剖小鼠的器官(心、肝、肺等)和肿瘤,进一步观察抗癌情况。
2结果和讨论
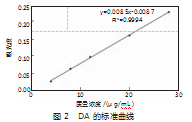
2.1 DA标准曲线
为方便后续载药量等实验的考察,根据线性关系得到的数据,绘制双氢青蒿素的标准曲线,如图2所示,得到y=0.008 5x-0.008 7,R2=0.999 4,其中,y是吸光度,x是双氢青蒿素浓度。
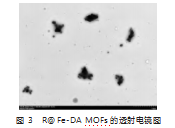
2.2 R Fe-DA MOFs的表征
TEM结果(图3)显示,R Fe-DAMOFs形状圆整,粒径分散均一、粒径约为250 nm。通过使用强酸HCl处理R Fe-DA MOFs使其负载的DA释放,结合标准曲线测得DA载药量为25.1%±1.09%,能满足后续研究需要。综上,本研究成功构建了粒径均一、形状结构理想且载药量较为理想的R Fe-DA MOFs递药系统。
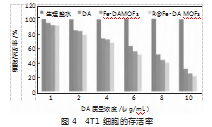
2.3 R Fe-DA MOFs的体外抗癌评价
通过MTT检测法评价R Fe-DA MOFs对4T1肿瘤细胞的抑制效果,结果如图4所示。图4所示为,DA经负载处理后,在1~10μg/mL质量浓度范围内对4T1细胞表现出明显的抑制效果,结果较为理想。而经过癌细胞膜再修饰后的R Fe-DA MOFs抑制效果再度得到提升,对4T1细胞的活性抑制最高可接近80%,与浓度呈线性关系,即浓度越高,抑制效果越好,4T1细胞存活率越低。结果表明,通过铁基有机框架的负载,DA的抗癌效果能得到明显提升,可能和显著提高了肿瘤细胞内的ROS含量有关。
2.4细胞内ROS含量测定
ROS含量测定结果如图5所示,在相同培养条件下,空白对照组的荧光强度最低,表明癌细胞虽也含有ROS,但含量过低不足以诱导铁死亡。DA组相比于空白对照组,荧光强度得到增加,正说明DA的抗癌作用是通过ROS所介导的。其次,Fe-DA MOFs组的荧光亮度强于前两组,而R Fe-DA MOFs组的荧光亮度是最强的,这也就说明制备的R Fe-DA MOFs成功在细胞内创造了ROS风暴环境,ROS含量明显高于前两组,明显改善单DA产生ROS不足的问题,铁死亡抗癌效果更理想。

2.5 R Fe-DA MOFs的细胞摄取
良好的细胞摄取能力是R Fe-DA MOFs入胞发挥药效的关键一步。癌细胞膜可以通过同源靶向和膜融合作用与癌细胞膜相互作用,促进纳米粒子的靶向细胞摄取、采用荧光显微镜考察4T1细胞对R Fe-DA MOFs的摄取能力,4T1细胞和FITC标记的R Fe-DA MOFs共同培育24h,结果如图6所示,R Fe-DA MOFs纳米粒子可以高效摄取入胞,摄取性能较强,这有助于促进药物的有效进入细胞内,提高治疗效果和生物利用率。

2.6 R Fe-DA MOFs的体内抗癌评价
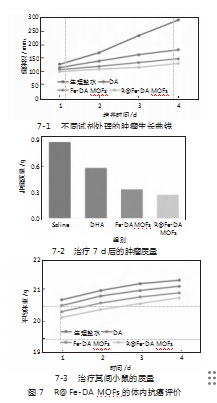
最后,选用小鼠乳腺癌(4T1)动物模型评价R Fe-DA MOFs的体内抗肿瘤效果。荷瘤小鼠被随机分为4组(n=4),分别为生理盐水、DA溶液、Fe-DA MOFs和R Fe-DA MOFs,经过1周治疗。肿瘤体积变化曲线如图7-1所示。R Fe-DA MOFs在各组中表现最优,肿瘤生长最慢。7 d后,对肿瘤进行称重,Fe-DA MOFs组和R Fe-DA MOFs组的平均瘤重是生理盐水组的38%和31%(图7-2),而R Fe-DA MOFs组的抑瘤效果最显著。此外,治疗期间各治疗组小鼠的体重与对照组相比,没有显著差异(图7-3),说明R Fe-DA MOFs具有良好生物安全性。综上,R Fe-DA MOFs抑瘤活性最好,且生物相容性较好,可以作为潜在的治疗药物。
3结论
本研究基于ROS风暴策略,选用Fe-MOFs载体,成功构建R Fe-DA MOFs新型仿生递药系统,粒径均一且形状结构理想,载药量较大。细胞水平研究发现,R Fe-DA MOFs摄取性能优异,可诱发ROS风暴积累,增强了乳腺癌细胞的铁死亡。动物水平发现,R Fe-DA MOFs可以通过ROS风暴取得显著的抑瘤效果,且生物相容性好。所以,R Fe-DA MOFs递送系统为临床ROS风暴抗癌治疗开发提供了新的范式。
参考文献:
[1]Hyuna Sung,Jacques Ferlay,Rebecca L Siegel,et al.Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA-Cancer J.Clin.2021,71:209-249.
[2]Zhang H,Chen Q,Zhang X,et al.An intelligent and tumor-responsive Fe2+donor and Fe2+-dependent drugs cotransport system[J].ACS ap-plied materials&interfaces,2016,8(49):33484-33498.
[3]Yao Y,Ji P,Chen H,et al.Ferroptosis-based drug delivery system as a new therapeutic opportunity for brain tumors[J].Frontiers in Oncolo-gy,2023(13):1084289.
[4]Huang L,Zhu J,Xiong W,et al.Tumor-generated reactive oxygen species storm for high-performance ferroptosis therapy[J].ACS nano,2023,17(12):11492-11506.
[5]葛健文,陈浩,杨可欣,等.MOFs的制备及其载药性能初步评[J].山东化工,2023,52(17):31-33.
[6]张少波.红细胞膜作为疏水碳点和抗癌药物纳米载体用于近红外成像引导化疗[D].合肥:安徽医科大学,2023.
[7]吴承梓,张巍,万彦涛,等.盐酸羟胺/铁基MOFs/过硫酸盐体系降解磺胺嘧啶[J].中国环境科学,2021,41(6):2685-2697.
[8]任雅静,李慧,倪频越,等.基于细胞膜仿生策略的纳米颗粒在肿瘤治疗中的应用[J].自然杂志,2022,44(3):241-250.










