(9H-氧杂蒽-9-羰基)甘氨酸乙酯的电化学合成研究论文
2024-09-10 16:51:03 来源: 作者:liziwei
摘要:甘氨酸乙酯类结构作为许多生物活性化合物的关键结构基序和多用途的构建模块,一直是研究的热点。利用绿色可持续的电力作为输出能源,以氧杂蒽和异氰基乙酸乙酯为原料,通过电催化酰化反应来合成(9H-氧杂蒽-9-羰基)甘氨酸乙酯,利用核磁共振氢谱、核磁共振碳谱和质谱对其结构进行表征,并考察了在不同电极、电解质、电流、溶剂、温度条件下对其产率的影响。该方法收率较高,产物的原材料易获取,为合成甘氨酸乙酯类结构提供了一种独特的方案。
摘要:甘氨酸乙酯类结构作为许多生物活性化合物的关键结构基序和多用途的构建模块,一直是研究的热点。利用绿色可持续的电力作为输出能源,以氧杂蒽和异氰基乙酸乙酯为原料,通过电催化酰化反应来合成(9H-氧杂蒽-9-羰基)甘氨酸乙酯,利用核磁共振氢谱、核磁共振碳谱和质谱对其结构进行表征,并考察了在不同电极、电解质、电流、溶剂、温度条件下对其产率的影响。该方法收率较高,产物的原材料易获取,为合成甘氨酸乙酯类结构提供了一种独特的方案。
关键词:电化学合成;氧杂蒽;异氰基乙酸乙酯;甘氨酸乙酯
引言
N-酰基甘氨酸酯类结构由于特殊的理化性质,在医药、化工、农药、食品、化妆品等方面具有广泛的应用。如用于合成急、慢性腹泻,具有选择性脑啡肽酶抑制作用的右羟曲(dexecadotril)、消旋卡多曲(racecadotril),可作为凉味剂的薄荷醇甘氨酸酯,对脑损伤引起的神经功能缺失、记忆与智能障碍具有治疗作用的奥拉西坦。另外甘氨酸乙酯盐酸盐可合成菊酸乙酯化合物,N-乙酰甘氨酸乙酯可作为生产抗钩端螺旋体药咪唑酸乙酯的合成中间体。
N-酰基甘氨酸酯类结构的常见合成方法有酰化反应[7-9]、酯化反应[10-12]等。重庆医科大学药学院袁勇等[13]以氨基酸为起始原料,经过酯化反应,与醛形成亚胺中间体,钯碳还原胺化、氢化脱苄,最终合成N-甲基氨基酸酯。谭靖颖等[14]探究了一种含炔烃官能团的氨基酸酯衍生物的简便合成方法。以丝氨酸甲酯盐酸盐为起始原料,经胺醛缩合、取代反应、偶联反应、Appel溴化反应合成了2-(3-苯基丙基-2-炔基)氨基)-3-溴丙酸甲酯。刘倩等[15]以氯代水杨醛和L-苯丙氨酸、L-亮氨酸及L-甘氨酸的脂肪酸酯为原料,通过碱催化的席夫碱缩合反应,合成了6种N-(5-氯-2-羟苄基)席夫碱氨基酸酯及其还原产物N-(5-氯-2-羟苄基)氨基酸酯。而氧杂蒽结构作为一类重要的基础母核以其卓越的光物理性质、光稳定性和可控开关荧光的能力在光化学领域具有广泛应用。其中含有氧杂蒽结构的Rhodamine B系列化工试剂在荧光染料领域也备受关注,可用于合成选择性检测生物硫醇(包括谷胱甘肽(GSH)、半胱氨酸(Cys)和同型半胱氨酸(Hcys))的高灵敏度探针[16-18]。
近年来,电化学诱导的电氧化还原反应已经发展成为一种促进多种化学转化并具有极高价值的绿色合成方法[19-21]。电氧化还原促进的功能化转化由于其温和、安全、环保和绿色的优点,在自由基酰化过程构建各种有机化合物而受到关注。然而,通过电氧化还原促进的氧杂蒽与异氰基乙酸乙酯合成(9H-氧杂蒽-9-羰基)甘氨酸乙酯尚未见报道。本文创新性地提出了通过电化学促进的氧杂蒽与异氰酸酯的氧化酰化反应来合成(9H-氧杂蒽-9-羰基)甘氨酸乙酯的方法。该电化学转化不使用任何金属试剂和外部强氧化剂,为获得氧杂蒽取代的甘氨酸乙酯衍生物提供了一种简便实用、收率高且绿色环保的方法。
1实验部分
1.1主要仪器与试剂
仪器:Bruker AVANCE NEO 600MHZ全数字化超导核磁共振谱仪(德国Bruker公司);7800 ICP-MS型电感耦合等离子质谱仪(美国Agilent公司);DP3005B可调直流供应器(迈斯泰克电子有限公司);旋转蒸发器(北京信诺凯科技有限公司)。
试剂:邻羟基苯甲醛、2-环己烯酮、四丁基四氟硼酸铵(nBu4NBF4)、四丁基六氟磷酸铵(nBu4NPF6)、四丁基溴化铵(nBu4NBr)、四丁基碘化铵(nBu4NI)、四丁基氯化铵(nBu4NCl)、碘化钾(KI)、六氟磷酸钾(KPF6)、四氟硼酸锂(LiBF4)、冰醋酸(HOAc)(上海毕得医药科技股份有限公司);三氟甲磺酸钪(Sc(OTf)3)(国药集团化学试剂有限公司);氯苯、乙腈、异氰基乙酸乙酯、甲酸(HCOOH)、对甲基苯磺酸(TsOH)、三氟乙酸(CF3COOH)、乙二酸(安徽泽升科技有限公司);所用试剂均为分析纯。
1.2实验方法
1.2.1原料氧杂蒽1a的合成
氧杂蒽1a的合成路线如图1所示。
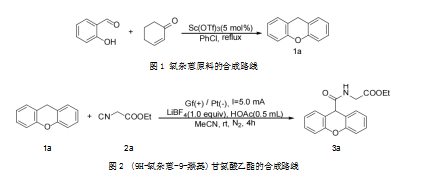
将邻羟基苯甲醛(1.22 g,10.00 mmol)、2-环己烯酮(1.06 g,11.00 mmol)、三氟甲磺酸钪(246.08 mg,0.50 mmol)和10 mL氯苯加入到50 mL双颈瓶中,180℃下搅拌回流反应16 h。反应结束后,冷却至室温,用乙酸乙酯和水萃取3次,合并有机相,使用饱和食盐水洗涤有机相一次后使用无水硫酸钠干燥,干燥后的有机相在45℃减压蒸馏30~45 min,蒸出溶剂,随后以石油醚和乙酸乙酯(50∶1)混合液为洗脱剂进行洗脱,经硅胶柱层析分离得到1.64 g,产率为90%。
1.2.2(9H-氧杂蒽-9-羰基)甘氨酸乙酯的合成路线
目标化合物3a合成路线如图2所示。
1.2.3实验步骤
化合物3a的合成:氧杂蒽(1a,91.11 mg,0.50 mmol)、异氰基乙酸乙酯(2a,84.83 mg,0.75 mmol)、电解质四氟硼酸锂(LiBF4,46.87 mg,0.50 mmol)、HOAc(0.5 mL)和6 mL CH3CN加入到反应管中。随后在反应溶液中插入石墨毡电极和铂电极(10 mm×20 mm×0.3 mm),将电流调节为恒流5.0 mA,在室温下搅拌反应4 h,反应完成后,用乙酸乙酯洗涤石墨毡电极3次,将洗涤液合并并将石墨毡电极浸泡在洗涤液中微波超声5 min,将反应液与微波超声后的洗涤液合并,有机相在45℃减压蒸馏30~45 min,蒸出溶剂,随后以石油醚和乙酸乙酯(6∶1)混合液为洗脱剂进行洗脱,经硅胶柱层析分离得到132.31 mg白色固体,产率为85%。1H NMR(600 MHz,Chloroform-d)δ7.42(d,J=7.8 Hz,2H),7.31(t,J=8.4 Hz,2H),7.17~7.10(m,J=7.8 Hz,4H),5.88(s,1H),4.92(s,1H),4.10(q,J=7.2 Hz,2H),3.88(d,J=5.4 Hz,2H),1.19(t,J=7.2 Hz,3H).13C NMR(150 MHz,CDCl3)δ172.2,169.7,151.5,129.9,129.7,124.1,119.0,117.4,61.8,47.0,41.9,14.4.HRMS(ESI)calcd for C12H13NO4[M+H]+:312.1231,found:312.1227。
2结果与讨论
2.1化合物3a的反应条件优化
2.1.1酸的筛选
将氧杂蒽(1a,91.11 mg,0.50 mmol)、异氰基乙酸乙酯(2a,84.83 mg,0.75 mmol)、电解质四氟硼酸锂(LiBF4,46.87 mg,0.50 mmol)、0.5 mL不同类的酸和6 mL CH3CN加入到电极反应管中。随后在反应溶液中插入石墨毡电极和铂电极(10 mm×20 mm×0.3 mm),将电流调节为恒流5.0 mA,在室温下搅拌反应4 h,反应完成后,用乙酸乙酯洗涤石墨毡电极3次,将洗涤液合并并将石墨毡电极浸泡在洗涤液中微波超声5 min,将反应液与微波超声后的洗涤液合并,有机相在45℃减压蒸馏30~45 min,蒸出溶剂,随后以石油醚和乙酸乙酯(6∶1)混合液为洗脱剂进行洗脱,经硅胶柱层析分离确定化合物3a的产率,如表1所示。
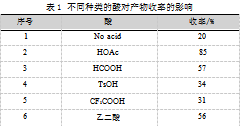
由表1可知,反应中没有酸的加入目标产物产率仅有20%,由此可见酸的加入是提升产率的重要条件(序号1);在酸的筛选中冰醋酸反应效果最好(序号2);反应中用甲酸代替醋酸,产率下降(序号3);当使用酸性明显强于乙酸的对甲苯磺酸和三氟乙酸时收益率有明显下降,可能该添加酸为阴极辅助产氢的作用,当酸性较强时,中间体亚胺不稳定,导致收率较低(序号4和序号5);乙二酸代替醋酸,产率下降(序号6)。
2.1.2电解质的筛选
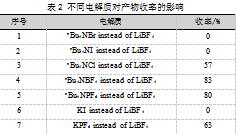
氧杂蒽(1a,91.11 mg,0.50 mmol)、异氰基乙酸乙酯(2a,84.83 mg,0.75 mmol)、电解质四氟硼酸锂(LiBF4,46.87 mg,0.50 mmol)、HOAc(0.5 mL)和6 mL CH3CN加入到电极反应管中。随后在反应溶液中插入石墨毡电极和铂电极(10 mm×20 mm×0.3 mm),将电流调节为恒流5.0 mA,在室温下搅拌反应4 h,反应完成后,用乙酸乙酯洗涤石墨毡电极3次,将洗涤液合并并将石墨毡电极浸泡在洗涤液中微波超声5 min,将反应液与微波超声后的洗涤液合并,有机相在45℃减压蒸馏30~45 min,蒸出溶剂,随后以石油醚和乙酸乙酯(6∶1)混合液为洗脱剂进行洗脱,经硅胶柱层析分离确定化合物3a的产率,如表2所示。
由表2可知,电解质的类型对反应结果有较大影响。nBu4NBr、nBu4NI两种电解质代替nBu4NClO4无化合物生成(序号1和序号3);nBu4NCl的产率较低,只有57%(序号2);nBu4NBF4、nBu4NPF6代替nBu4NClO4产率很好,分别为83%、80%(序号4和序号5);KI作电解质没有产物生成(序号6);KPF6代替nBu4NClO4产率降低,得到收率63%的目标产物(序号7)。最终确定反应的最佳电解质为LiBF4。
2.1.3其他反应条件的筛选
氧杂蒽(1a,91.11 mg,0.50 mmol)、异氰基乙酸乙酯(2a,84.83 mg,0.75 mmol)、电解质四氟硼酸锂(LiBF4,46.87 mg,0.50 mmol)、HOAc(0.5 mL)和6 mL CH3CN加入到电极反应管中。插入不同电极,通持续电流或不通电,加入相应溶剂,搅拌反应4 h,反应完成后,用乙酸乙酯洗涤石墨毡电极3次,将洗涤液合并并将石墨毡电极浸泡在洗涤液中微波超声5 min,将反应液与微波超声后的洗涤液合并,有机相在45℃减压蒸馏30~45 min,蒸出溶剂,随后以石油醚和乙酸乙酯(6∶1)混合液为洗脱剂进行洗脱,经硅胶柱层析分离确定化合物3a的产率,如表3所示。
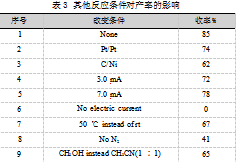
由表3可知,用Pt/Pt、C/Ni电极代替C/Pt电极都会使产率下降(序号2和序号3);改变电流3.0 mA、5.0 mA产率都略有降低(序号4和序号5);条件优化证实了通持续电流的必要性,无电流产率为0(序号6);该反应对温度变化较敏感,提高温度到50℃产率减少(序号7);反应不在N2氛围下,产率会降低(序号8);溶剂变为CH3OH产率也会下降(序号9)。因此,氧杂蒽和异氰基乙酸乙酯制备(9H-氧杂蒽-9-羰基)甘氨酸乙酯的最佳条件是0.50 mmol氧杂蒽和0.75 mmol异氰基乙酸乙酯作为反应物,0.50 mmol的LiBF4作为电解质,加入0.5 mL的HOAc,6 mL CH3CN作为溶剂,氮气氛围下,设定恒流电5.0 mA在室温下反应4 h。
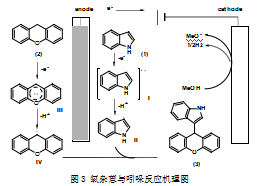
2.2反应机理
李洪基课题组[22]提出了氧杂蒽与吲哚的反应机理。如图3所示,在电化学催化,氧杂蒽(2)在阳极表面被单电子氧化,产生自由基阳离子中间体III,自由基阳离子III经过脱质子化得到了自由基IV。吲哚(1)在阳极表面被单电子氧化,产生自由基阳离子中间体I,自由基阳离子I经过脱质子化得到了自由基II。接下来,自由基II与自由基IV反应形成了产物(3)。溶液中的H+在阴极表面被还原为氢气。
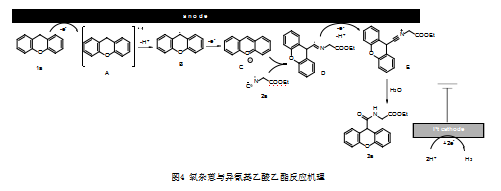
基于实验结果,图3反应机理图和以往报道[23-25],图4提出了本合成路线一种可能的反应机理。最初,氧杂蒽1a经阳极氧化变为自由基阳离子中间体A,然后进一步脱质子得到苄基自由基中间体B。然后,苄基自由基中间体B被氧化为阳离子中间体C,然后,阳离子中间体C与异氰基乙酸乙酯反应形成自由基中间体D,中间体D被单电子氧化去氢得到以N为中心的腈阳离子中间体E。最后,通过H2O对腈中间体E的亲核攻击产生所生成产物3a。阴极反应为H+还原为氢气。
3结语
本研究用氧杂蒽和异氰基乙酸乙酯作为底物合成了(9H-氧杂蒽-9-羰基)甘氨酸乙酯化合物,深度探究了不同条件对该反应收率的影响。其中值得注意的是HOAc的加入对产物的合成有着极大的促进作用。另外不同电解质、电极、温度和溶剂等对收率都有不同程度的影响,氮气氛围是反应的重要条件。目标化合物结构通过1H NMR、13C NMR和HRMS确证。该反应具有简单易处理、产率较高、绿色环保等特点,通过电催化方法合成(9H-氧杂蒽-9-羰基)甘氨酸乙酯化合物可为今后该类型结构的绿色合成提供新的思路。
参考文献:
[1]MONTEIL T,DANVY D,SIHEL M,et al.Strategies for access to enantiomerically pure ecadotril,dexecadotril and fasidotril:a review[J].Mini-reviews in medicinal chemistry,2002,2(3):209-217.
[2]MATHESON A J,NOBLE S.Racecadotril[J].Drugs,2000,59(4):829-835.
[3]KLUMPP D A,SOBEL R M,KOKKINIDOU S G,et al.Synthesis of menthol glycinates and their potential as cooling agents[J].ACS omega,2020,5(8):4043-4049.
[4]YAO X,YAO Z H,LI L,et al.Oxiracetam can improve cognitive impairment after chronic cerebral hypoperfusion in rats[J].Psychiatry research,2016,246:284-292.
[5]WANG J X,XIANG J C,WU M H,et al.Design,synthesis,and insecticidal activities of novel meta-diamide compounds containing ethyl acetate and their derivatives[J].Chemistry&biodiversity,2023,20(4):e202300060.
[6]厦门莱恩斯特信息科技有限公司.一种咪唑酸乙酯药物中间体乙酰甘氨酸乙酯的合成方法:CN201610827825.X[P].2017-02-22.
[7]潘春,唐龙,李欢,等.N-椰油酰基甘氨酸钠表面活性剂的合成研究[J].当代化工,2022,51(6):1375-1379.
[8]沙文彬,黄文华.N-(3-甲酰基苯基)甘氨酸衍生物的合成[J].化学试剂,2013,35(11):963-966.
[9]姜国民,陈洪霞,徐清清,等.重氮化合物的N-H插入反应合成N-乙酰基-2-芳基甘氨酸酯[J].南通大学学报(自然科学版),2007(4):46-50.
[10]潘婷婷.癸酸酰基甘氨酸钠的合成[J].商洛学院学报,2016,30(6):53-57.
[11]刘群.改进肖顿—鲍曼反应合成N-酰基甘氨酸钠的探索[D].无锡:江南大学,2017.
[12]刘群,胡学一,方云.月桂酸甲酯与甘氨酸钠在甘油中合成N-月桂酰基甘氨酸钠[J].精细化工,2016,33(7):768-771,810.
[13]袁勇,李雁武,李伦,等.一种N-甲基氨基酸酯的合成方法[J].化学研究与应用,2015,27(3):349-353.
[14]谭靖颖,洪玉,刘宇轩,等.含炔烃的氨基酸酯的简便合成研究[J].化工技术与开发,2023,52(6):14-16.
[15]刘倩,卢俊瑞,辛春伟,等.N-(5-氯-2-羟苄基)氨基酸酯的合成、表征及抑菌活性[J].应用化学,2010,27(9):1012-1016.
[16]XUE H,YU M,HE K,et al.A novel colorimetric andfluorometric probe for biothiols based on MnO2 NFs-Rhodamine B system[J].Analytica chimica acta.2020,1127:39-48.
[17]WU Y,SHI A,LIU H,et al.A novel near-infrared xanthene-basedfluorescent probe for detection of thiophenoin vitro and in vivo[J].New journal of chemistry,2020,44(40):17360-17367.
[18]KIM H N,LEE M H,KIM H J,et al.A new trend in rhodamine-based chemosensors:application of spirolactam ring-opening to sensing ions[J].Chemical society reviews,2008,37(8):1465-1472.
[19]LI T C,YANG J Y,YIN X,et al.Visible-light-mediated aerobic Ritter-type C–H amination of diarylmethanes using DDQ/tert-butyl nitrite[J].Organic&biomolecular chemistry,2022,20(44):8756-8760.
[20]RUSSO C,GRAZIANI G,CANNALIRE R,et al.Visible-light photocatalytic metal-free multicomponent Ugi-like chemistry[J].Green chemistry,2022,24(10):3993-4003.
[21]WANG L,FERGUSON J,ZENG F.Palladium-catalyzed direct coupling of 2-vinylanilines and isocyanides:an efficient synthesis of 2-aminoquinolines[J].Organic&biomolecular chemistry,2015,13(47):11486-11491.
[22]CHEN XY,LIU H Q,GAOH,et al.Electrochemical regioselective cross-dehydrogenative coupling of indoles with xanthenes[J].The journal of organic chemistry,2022,87(2):1056-1064.
[23]YU X,SONG S J,ZHANG Z H,et al.Electro-chemical oxidative carbon-atom multifunctionalization and N-cyanation of imine:Synthesis of(Z)-N’-cyano-N-carbamimidothioate[J].Advanced synthesis&catalysis,2023,365(10):1640-1645.
[24]ZHANG X,YUAN Q L,ZHANG H X.Electro-chemical synthesis of oxazoles via a phosphine-mediated deoxygenative[3+2]cycloaddition of carboxylic acids[J].Green chemistry,2023,25:1435-1441.
[25]YAN K,LIU M,WEN J,et al.Visible-light-promoted cascade cyclization towards benzo[d]imidazo[5,1-b]thiazoles under metal-and photocatalyst-free conditions[J].Green chemistry,2021,23(3):1286-1291.










