细菌外膜囊泡在疫苗领域的应用研究进展论文
2024-04-30 12:08:40 来源: 作者:liyuan
摘要:细菌外膜囊泡(outer membrane vesicles,OMVs)是一种由革兰阴性菌在生长过程中分泌的 纳米球状颗粒,通过释放毒力因子、调控宿主免疫反应、外排抗生素等途径参与细菌感染性疾病的 发生过程。由于 OMVs携带大量细菌组分,如蛋白质、脂质、遗传物质等,可以有效激活免疫系统,具 有作为疫苗、疫苗佐剂以及优良外源抗原载体的潜力,可用于传染性疾病预防疫苗和肿瘤免疫治疗 疫苗的开发研制过程中。随着医药和生物技术等高新产业的迅速发展,现有疫苗都被发现存在不同 的缺陷,亟需一种能够同时保证安全性与有
摘 要:细菌外膜囊泡(outer membrane vesicles,OMVs)是一种由革兰阴性菌在生长过程中分泌的 纳米球状颗粒,通过释放毒力因子、调控宿主免疫反应、外排抗生素等途径参与细菌感染性疾病的 发生过程。由于 OMVs携带大量细菌组分,如蛋白质、脂质、遗传物质等,可以有效激活免疫系统,具 有作为疫苗、疫苗佐剂以及优良外源抗原载体的潜力,可用于传染性疾病预防疫苗和肿瘤免疫治疗 疫苗的开发研制过程中。随着医药和生物技术等高新产业的迅速发展,现有疫苗都被发现存在不同 的缺陷,亟需一种能够同时保证安全性与有效性的疫苗,由此可见,外膜囊泡疫苗具有良好的应用 前景。本文就细菌外膜囊泡的生物合成、结构组分、生物学作用及其在疫苗领域的应用等各个方面 的研究进行综述分析,为进一步推动细菌外膜囊泡疫苗的研发提供了一定的理论基础和借鉴价值。
关键词:细菌外膜囊泡;生成机制;疫苗;佐剂;药物递送
1963 年,研究人员通过电子显微镜首次在细菌 的 细胞 壁 处 发现 了外 膜 囊 泡 (outer membrane vesicles,OMVs)[1-2],因对其组成、结构和功能均不清 楚,固认为其是细胞凋亡所产生的细胞碎片[3]。1987 年,Johnstone 等[4]发现羊网状细胞能够分泌纳米级 囊泡,并将其命名为外泌体(exosome)。此后,越来越 多文献开始报道革兰氏阴性菌可分泌类似外泌体的 囊泡[5],功能与细胞外泌体相似,被称为细菌外膜囊 泡。1999 年,Beveridge 等[6]对铜绿假单胞菌 OMVs 的 系列研究最早揭示了 OMVs 的天然杀菌活性及其成 为抗菌药物载体的潜力。至此,对 OMVs 的研究开始 引起了人们的广泛重视。起初人们对 OMVs 的研究 主要集中于对其功能的探索,但随着对 OMVs 生物 合成、组成分析的深入研究,OMVs 的结构、生物学 作用和免疫作用逐渐清晰了起来。随着研究的不断 深入,OMVs 已被认为是疫苗研发过程中潜在的疫 苗抗原候选物之一。本文对 OMVs 的结构研究及其 在疫苗相关领域的应用进展进行综述,以期为OMVs 在疫苗开发领域、药物递送系统,乃至抗菌 剂、靶向治疗肿瘤等医学领域的应用研究提供参考 和理论支撑。
1 细菌外膜囊泡
1.1 合成机制
OMVs 起初被认为是细菌裂解的副产物,但随 后 OMVs 被证实是由原核微生物分泌产生的,有关 其产生的具体机制开始变得说法不一[7]。 目前被大 部分学者普遍接受的观点是,OMVs 的形成及其携 带的物质并不是随细菌死亡而随机产生的,而是存 在一种精细有序的调控过程[8]。当前研究认为 OMVs 的生物合成调控机制主要包括三种,即压力聚集、膜 交联调节、脂类富集,如图 1 所示。
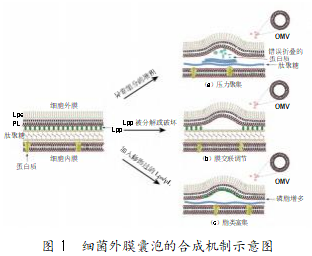
细胞周质中存在大量肽聚糖片段和错误折叠的 蛋白质以及一些促进膜囊泡等物质生成的异常组 分,这些异常组分的局部堆积和富集会给细胞膜造 成压力,降低包膜的完整性,使肽聚糖层由外膜层分离,向外突出形成 OMVs[9-10]。如幽门螺杆菌[11]和波伊 德志贺菌[12]就是通过这种调节机制产生 OMVs 的。
革兰阴性菌的膜结构分为内膜层、肽聚糖层 (PG)和外膜层 3层[13]。周质腔中的脂蛋白(lipoprotein, LPP)可以通过 Lpp-PG 的方式连接细菌的外膜层和 肽聚糖层,使其被分解或破坏,导致外膜层和肽聚糖 层两层之间的连接变得不稳定,最终导致外膜凸起 形成球状囊泡,引发 OMVs 的产生和释放[1]。与之相 反,如果缺少 mDAP-mDAP 肽连接,就会引起 Lpp- PG 连接的上升,导致 OMVs 的产量下降[9]。如大肠杆 菌和沙门氏菌在缺少 ompA 的情况下,OMVs 的产 量会显著上升[14-16]。
外膜中富集有大量脂质,这些脂质会影响膜的 曲率与流动性,因此脂质可能会在 OMVs 的分泌形 成过程发挥关键作用。有研究指出,当在外膜中加 入修饰过的脂多糖(lipopolysac-charide,LPS)或磷 脂等成分后,外膜的曲率会发生变化,从而诱导更多 OMVs 的形成与释放[1,17]。此外,温度变化也会影响 OMVs 的产量。温度的调节会影响膜上脂质的流动 性,但温度对不同种属菌类的影响也不同。在大肠 杆菌中,随着温度升高,膜上脂类的流动性会不断增 强,OMVs 的产量会增加;而在铜绿假单胞杆菌中,温 度升高 12 ℃或 14 ℃都不会改变 OMVs 的产量[18]。
1.2 结构和组成
OMVs 是一种由双层膜包裹的球状纳米颗粒, 直径范围为 20~250 nm。但这种结构并不是绝对的。 有研究发现,除了 OMVs 双层膜球形结构,研究人员 在某些古细菌(Archaebacteria)上还发现了管型、细长型等其他结构类型[19]。OMVs 主要由细胞外膜的 成分组成,包括丰富的外膜蛋白、脂多糖、肽聚糖以 及一系列与宿主组织黏附和侵袭有关的毒力因子, 同时也包含一些细胞内成分,例如 DNA,RNA 和酶 等,这些组成成分同样决定了其对细菌多种生物过 程的影响能力,包括生物膜的形成、DNA 转移、细胞 代谢物和毒力因子的运输等。随着蛋白质组学技术 的进步,在 OMVs 中已经鉴定出了很多不同功能类 别的蛋白质[20]。如参与细菌对宿主黏附和侵染的 OM 蛋白(OmpA、OmpC 和 OmpF)和周质蛋白(AcrA、碱 性磷酸酶)。
脂质是 OMVs 的重要结构成分。Horstman 等[21] 报道大肠埃希杆菌 OMVs 以甘油磷脂、磷脂酰甘油、 磷脂酰乙醇胺和心磷脂为主要脂质 ,这些脂质与 OMVs 的曲度有关。有研究报道 OMVs 中亦存在一 些不属于细菌外膜成分的脂质[22],还有些学者猜测 OMVs 所包含的核酸是细菌裂解残留物偶然渗入 的,也有学者认为其生物发生过程并非偶然现象[23]。
1.3 生物学作用
几乎所有的革兰氏阴性菌都会产生 OMVs,可 见 OMVs 的存在对细菌的意义之大。目前普遍认为 OMVs 对革兰氏阴性菌的生物学作用主要包括信息 交流、营养摄取、防御作用和环境压力耐受这四个方 面。OMVs 装载了多种来自亲本细菌的生物分子和 外源性生物分子,这些生物分子会随 OMVs 的传递 进行细胞间的信息交流。如铜绿假单胞菌外膜囊泡 包裹喹诺酮信号(PQS)分子,喹诺酮信号分子以 OMVs 为载体,在细菌群体内进行信息传递。
OMVs 所含的组分十分复杂,包含许多可以降 解生物大分子的酶类物质。因此,当细菌所生活的环 境中存在某些大分子类物质时,OMVs 便可以将其 降解并使其被细菌吸收利用。此外,OMVs 还可以与 细菌细胞膜融合,有助于细菌获取营养物质。如百日 咳杆菌外膜囊泡可充当铁输送系统,在铁限制的条 件下可以补充百日咳杆菌的生长缺陷[24]。
病原体定植于宿主组织的恶劣环境中时可能会 遇到多种压力源,病原体为了对抗压力和生存,就会 建立多种防御机制 ,其中之一就是释放 OMVs。 OMVs 在此过程中会充当诱饵,保护细菌细胞免受 抗生素、抗菌肽和噬菌体等的伤害。如在对鲍氏不动杆菌(A cinetobacter baumannii)的研究中发现,β-内 酰胺酶基因 blaOXA-24 为阳性的 OMVs 可以将其 传递给阴性菌株使其获得耐药基因[2,25]。
OMVs 的形成理论中有这样一种观点,即释放 出来的 OMVs 可以携带菌体本身合成的一些错误折 叠的蛋白或过量的肽聚糖片段,是细菌处理“垃圾” 的一种方式。细菌也可以通过释放 OMVs 将这些垃 圾释放出去,从而减轻其环境压力。如用环氧沙星 处理铜绿假单胞菌,该细菌便会通过释放 OMVs 来 抵抗不良生存环境[1]。
2 细菌外膜囊泡在疫苗研发中的应用
2.1 作为候选疫苗
OMVs 疫苗可以诱导机体产生高抗体,使其具 有更高的有效性。研究表明,OMVs 中含有众多抗原 蛋白且不具有复制能力,接种 OMVs 疫苗可以诱导 机体产生多种具有杀菌活性的抗体,且其在动物模 型中具有免疫保护功能[26]。这一特质使 OMVs 成为 了疫苗研发环节的优质候选抗原。
OMVs 疫苗作为一种极具潜力的疫苗种类,具 有成本低、可以诱导有效的保护性免疫应答等优点。 2013 年,商品名为 Bexsero 的针对引发流行性脑脊 髓膜炎而研发生产的 B 型脑膜炎耐瑟菌 OMVs 疫 苗在欧洲成功获批上市,并在古巴、智利、挪威和新 西兰等地投入使用[27]。除了针对脑膜炎球菌的OMVs 疫苗,结核分枝杆菌[28]、金黄色葡萄球菌[29]等其他细 菌的 OMVs 疫苗也正处于研发阶段。此外,用于治疗 莱姆病的脑膜炎奈瑟菌 OMVs 疫苗[30],治疗产肠毒 素大肠杆菌的霍乱弧菌 OMVs 疫苗[31],治疗肺炎的 鼠伤寒沙门菌 OMVs 疫苗[32]以及治疗肺结核的异源 OMVs 疫苗[33]等也正处于研究过程中。这些疫苗的 研发不仅说明 OMVs 在 B 群脑膜炎球菌疫苗领域 的研究已经得到了广泛认可,更证明了 OMVs 作为 候选抗原的优势和发展前景[34]。
除此之外,有些菌的 OMVs 疫苗还可以用来缓 解患者的炎症。如百日咳菌的 OMVs 疫苗在降低患 者炎性反应的同时,也具有与其他疫苗相同的保护 作用[2]。
2.2 作为佐剂
疫苗佐剂(adjuvant)能够非特异性地改变或增强机体对抗原的特异性免疫应答,诱发机体产生长 期、高效的特异性免疫反应,增强机体的保护能力, 与此同时还可减少免疫物质的用量,降低疫苗的生 产成本。目前关于佐剂的研究主要集中于两方面,一 是受体激活剂,二是疫苗的递送系统[35-36]。OMVs 表 面的脂多糖(Lipopolysaccharide,LPS)是 Toll 样受体 4(toll-like receptor 4,TLR4)的典型激活剂。激活这 些信号通路不仅可以诱导细胞释放大量可以介导多 项免疫反应的促炎性细胞因子,还可以促进抗原递 呈细胞成熟并用于激活适应性免疫[1] 。由此可见, OMVs 表面的 LPS 可以作为很好的免疫激活剂,且 具有很大的研究价值。
将 OMVs 用作佐剂的研究可以追溯到二十世纪 末[37]。在 HIV 疫苗的研究过程中,OMVs 佐剂被证明 可以诱导 T 细胞反应[38]。Nagaputra 等[39]研究表明,脂 多糖(LPS)修饰糖型(LgtB-LpxL1)与非修饰糖型 Lpxl1 血清组脑膜炎球菌 H44/76 天然外膜囊泡 (nOMVs)对重组脑膜炎球菌蛋白、破伤风类毒素或 脑膜炎球菌 C 血清群荚膜多糖等具有佐剂作用,能 够取得与传统佐剂相同甚至优于传统佐剂的效果。
2.3 作为药物递送系统
OMVs 相对稳定,可以保护内部物质免受细胞 内核酸酶与蛋白质水解酶降解[21,40-41]。有研究表明, OMVs 可在 4 ℃下长期储存,甚至在短暂的高温作 用下仍能保持酶活性和抗原性[42]。而且,其不会因长 距离运输而降解,由此可解决疫苗长距离运输抗原 活性低的问题。有研究表明,利用基因工程技术可使 OMVs 负载的抗原不仅可以暴露于 OMVs 表面,也 可以负载于 OMVs 的腔体中[43-44] 。上述技术优势一 方面可以保护 OMVs 内的抗原,另一方面还可以于 OMVs 表面在其他外源抗原的帮助下将内部抗原靶 向递呈于抗原递呈细胞中。
目前 OMVs 领域一个新的研究方向是将异源抗 原表达于 OMVs 表面从而构建新疫苗。目前,已有学 者通过基因工程改造技术将甲型流感病毒的基质蛋 白 M2 异源表达于大肠杆菌的外显子中,并成功表 达出了包含此蛋白的 OMVs,通过动物实验进行临 床检验,证明此种方式制得的疫苗可以抵抗同型流 感病毒的攻击[45]。OMVs 疫苗相较其他疫苗具有更 高的可修饰性,可通过基因工程等手段加强疫苗的靶向性,由此可见,OMVs 疫苗拥有更广泛的研究方 向。

3 细菌外膜囊泡的其他领域的应用
3.1 作抗菌剂的研究
细菌需要附着于宿主细胞并定植在相关组织 中,然后再扩散到其他组织,才能感染机体[46]。目前, 已经出现了一种通过使用抗菌黏附剂来抑制细菌的 黏附作用从而治疗感染的新型抗菌治疗方法,其被 称为抗菌黏附疗法[47]。抗菌黏附剂主要通过破坏细 菌上的黏附素或竞争性,与宿主细胞结合来抑制细 菌与宿主细胞结合[48]。
OMVs 中含有较多细菌黏附素,这种性质决定 了 OMVs 可以竞争性地与宿主细胞结合,起到抗菌 黏附剂的作用。Zhang 等[49]通过带有黏附素的幽门杆 菌 OMVs 包裹纳米颗粒,构建了一种抗菌黏附剂纳 米平台。其实验结果显示,该 OMVs 纳米平台能够降 低幽门杆菌对宿主细胞的黏附性,同时,通过对小鼠 胃组织幽门杆菌的研究也证实了该 OMVs 可以削弱 细菌的黏附作用。
3.2 在医疗用药方面的应用
OMVs 对细菌的一个重要作用就在于可以为其 提供适宜的生存环境。细菌在产生应激反应对会产 生更多 OMVs,而抗生素就是刺激细菌产生 OMVs 的因素之一。肠出血性大肠埃希菌分泌的志贺毒素 2a 会引起溶血性尿毒综合征。研究发现[50],磷霉素、 环丙沙星等抗生素会刺激出血性大肠埃希菌 O104: H4 和 O157 ∶H7 产生 OMVs,其中,环丙沙星还会 使 OMVs 中的志贺毒素含量增加。因此,治疗此类患 者时不应使用上述抗生素。同时,细菌遇到抗生素 发生应激反应产生 OMVs 的性质也可以应用于 OMVs 的制备过程中。
3.3 抗肿瘤应用研究
OMVs 作为一种不具有分裂能力、稳定度较高 的纳米粒子,包含母体细菌的主要免疫原性蛋白质, 可以有效激活免疫系统,特异性杀伤异常的肿瘤细 胞,同时还可以高效转运药物。以上性质使 OMVs 成 为了一种治疗肿瘤的新型手段[26]。
正常情况下,人体的免疫系统可以识别并清除 肿瘤细胞,但肿瘤细胞可以通过破坏抗肿瘤-免疫循环,实现“免疫逃逸”,得以不受控制地生长。肿瘤 免疫治疗主要通过重新激活机体的抗肿瘤-免疫循 环来杀死肿瘤细胞[51-52]。Li 等[53]通过融合大肠杆菌 OMVs 和黑色素瘤细胞膜(TCMs)即 BTs,整合 PLGA 到 BTs 中作为核心形成 BTs@PLGA,开发有 效的囊泡疫苗。BTs@PLGA 的治疗显著增强了 DC 靶向、DC 成熟、肿瘤抗原呈递以及抗原特异性 T 细 胞的反应,具有良好的抗肿瘤治疗效果。
4 总结与展望
鉴于上述 OMVs 疫苗区别于其他疫苗的优点, 以及已开发的 OMVs 疫苗平台 ,我们可以看出 OMVs 疫苗应用领域广泛且拥有良好的发展前景。 OMVs 疫苗的应用研究已成为国内外研究的热点, 但是, 目前有关 OMVs 疫苗的研究和应用主要是针 对细菌引起的相关疾病,而针对病毒研发的 OMVs 疫苗却少之又少。
2019 年末新型冠状病毒肺炎肆虐中国,开发拥 有长效免疫能力且能够应对不同变种新型冠状病毒 的疫苗是预防疾病、增强机体抵抗力的一种高效方 法。目前市场上常见的针对新冠病毒的疫苗主要分 为三种,一是新冠灭活疫苗,二是新冠腺病毒载体疫 苗,三是新冠重组蛋白疫苗。虽然这三种病毒均对抑 制新冠肺炎具有一定的有效性,但都各有缺点,并且 在注入人体后均会引发一系列不良反应,而有研究 证明百日咳菌的 OMVs 疫苗在使机体产生的炎症反 应更少的情况下,可以起到相同的保护作用[2],由此 可推断新冠病毒的 OMVs 疫苗也可能拥有相同的防 护效果。因此,研制针对新冠病毒的 OMVs 疫苗具有 重要的研究价值和应用前景。
参 考 文 献
[1] YAO S Y, SUN S X. Research progress of bacterial outer membrane vesicles in the field of vaccines[J]. Progress in Microbiology and Immunology, 2021, 49(1): 78-82.
[2] 姚崧源, 孙述学. 细菌外膜囊泡在疫苗领域的研究进展 [J]. 微生物学免疫学进展, 2021, 49(1): 78-82.
[3] ZHAO G F, LEI G H, PENG Y Y. Research Progress on Mechanism, Function and Application of Bacterial Outer MembraneVesicle Synthesis[J]. Chinese Journal ofPreventive Veterinary Medicine, 2018, 40(8): 761-765.
[4] 赵光夫, 雷桂花, 彭远义. 细菌外膜囊泡合成机制、功能 及应用研究进展[J]. 中国预防兽医学报, 2018, 40(8): 761-765.
[5] KNOX K W, VESK M, WORK E. Relation between excreted lipopolysaccharide complexes and surface structures of a lysine-limited culture of Escherichia coli [J]. Bacteriology, 1966, 92(3): 1206-1217.
[6] Johnstone R M, Adam M, Hammond J R, et al. Vesicle formation during reticulocyte maturation. Association of plasma membrane activities with released vesicles (exosomes)[J]. Biological Chemistry, 1987, 262(19): 9412.
[7] ZHOU S Y, ZHANG P Q, DAI X D, et al. Research progress of bacterial outer membrane vesicles (OMVs)[J]. Chinese Journal of Microbiology, 2021, 41(6): 83-89.
[8] 周舒扬, 张丕奇, 戴肖东, 等. 细菌外膜囊泡( OMV)研 究进展[J]. 微生物学杂志, 2021, 41(6): 83-89.
[9] BEVERIDGE TJ. Structures of gram-negative cell walls and their derived membrane vesicles[J]. Journal of Bacteriology, 1999, 181(16): 4725-4733.
[10] TOYOFUKU M, NOMURA N, EBERL L. Types and origins of bacterial membrane vesicles[J]. Nature Reviews Microbiology, 2019, 17(1): 13-24.
[11] SCHWECHHEIMER C, KUEHN M J. Outer-membrane vesicles from Gram-negative bacteria: biogenesis and
functions[J]. Nature Reviews Microbiology, 2015, 13(10): 605-619.
[12] SCHWECHHEIMER C , KULP A , KUEHN M J . Modulation of bacterial outer membrane vesicle production by envelope structure and content[J]. BMC Microbiology, 2014,14(1): 324.
[13] LIU C, LI G L. Research on Bacterial Outer Membrane Vesicles and Its Application Progress in the Field of Medical Biotechnology[J]. China Medical Biotechnology, 2018, 13(5): 452-457.
[14] 刘畅, 李桂玲. 细菌外膜囊泡的研究及其在医药生物 技术领域的应用进展[J]. 中国医药生物技术, 2018, 13
(5): 452-457.
[15] TURNER L, PRASZKIER J, HUTTON M L, et al. Increased Outer Membrane Vesicle Formation in a Helicobacter pylori tolB Mutant[J]. Helicobacter, 2015, 20(4): 269-283.
[16] MITRA S, SINHA R, MITOBE J, et al. Development of a cost-effective vaccine candidate with outer membrane vesicles of a tolA-disrupted Shigella boydii strain[J].Vaccine, 2016, 34(15): 1839-1846.
[17] SILHAVY T J, KAHNE D, WALKER S. The Bacterial Cell Envelope[J]. Cold Spring Harbor Perspectives in Biology, 2010, 2(5): a000414.
[18] DEATHERAGE B L, LARA J C, BERGSBAKEN T, et al. Biogenesis of bacterial membrane vesicles[J]. Molecular Microbiology, 2010, 72(6): 1395-1407.
[19] SONG T, MIKA F, LINDMARK B, et al. A new Vibrio cholerae sRNA modulates colonization and affects release of outer membrane vesicles[J]. Molecular Microbiology, 2008, 70(1): 100-111.
[20] SONNTAG I, SCHWARZ H, HIROTA Y, et al. Cell envelope and shape of Escherichia coli: multiple mutants missing the outer membrane lipoprotein and other major outer membrane proteins[J]. Journal of Bacteriology, 1978, 136(1): 280-285.
[21] MASHBURN L M, WHITELEY M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote[J]. Nature, 2005, 437(7057): 422-425.
[22] BIAN Z B, LI B, GOU H C, et al. Research progress of
outer membrane vesicles of Gram-negative bacteria[J]. Animal Husbandry and Veterinary Medicine, 2020, 52 (05): 136-142.
[23] 卞志标, 李冰, 勾红潮, 等. 革兰阴性菌外膜囊泡的研
究进展[J]. 畜牧与兽医, 2020, 52(5): 136-142.
[24] MARGUET E, GAUDIN M, GAULIARD E, et al.
Membrane vesicles, nanopods and/or nanotubes produced by hyperthermophilic archaea of the genus Thermococcus [J]. Biochemical Society Transactions, 2013, 41 (1): 436-442.
[25] KIM Y S, CHOI E J, LEE W H, et al. Extracellular
vesicles, especially derived from Gram-negative bacteria, in indoor dust induce neutrophilic pulmonary inflammation associated with both Th1 and Th17 cell responses[J]. Clinical and Experimental Allergy, 2013, 43 (4): 443-454.
[26] HORSTMANAL, KUEHNM J.Enterotoxigenic Escherichia coli secretes active heat-labile enterotoxin via outer membrane vesicles[J]. Journal of Biological Chemistry, 2000, 275(17): 12489-12496.
[27] KATO S, KOWASHI Y, DEMUTH D R. Outer membrane-like vesicles secreted by Actinobacillus actinomycetemcomitans are enriched in leukotoxin[J]. Microbial Pathogenesis, 2002, 32(1): 1-13.
[28]CHENG Q,WU J,WANG D.Research progress of bacterial outer membrane vesicles related to antibiotics[J].Chinese Journal of Antibiotics,2019,44(10):1119-1124.
[29]程谦,吴疆,王岱.细菌外膜囊泡与抗生素相关的研究进展[J].中国抗生素杂志,2019,44(10):1119-1124.
[30]LIU Z L,PAN C,ZHU L,et al.Research progress of pertussis outer membrane vesicles and its potential as a novel alternative vaccine[J].Chinese Journal of Biological Products,2021,34(3):367-371.
[31]刘兆禄,潘超,朱力,等.百日咳外膜囊泡的研究进展及其作为新型替代疫苗的可能性[J].中国生物制品学杂志,2021,34(3):367-371.
[32]JAGANNADHAM M V,CHATTOPADHYAY M K.Role of outer membrane vesicles of bacteria[J].Resonance,2015,20(8):711-725.
[33]KAPARAKIS-LIASKOS M,FERRERO R L.Immune modulation by bacterial outer membrane vesicles[J].Nature Reviews Immunology,2015,15(6):375-387.
[34]ZHANG M M,WANG G Q,XU F.Research progress of outer membrane vesicles of Gram-negative bacteria and its mechanism of action[J].Chinese Veterinary Science,2021,51(9):1182-1189.
[35]张蒙蒙,王桂琴,徐飞.革兰阴性菌外膜囊泡及其作用机制的研究进展[J].中国兽医科学,2021,51(9):1182-1189.
[36]PRADOS-ROSALES R,CARREOL J,BATISTA-GONZALEZ A,et al.Mycobacterial membrane vesicles administered systemically in mice induce a protective immune response to surface compartments of Mycobacterium tuberculosis[J].mBio,2014,5(5):e01921.
[37]CHOIS J,KIMM H,JEON J,et al.Active Immunization with extracellular vesicles derived from Staphylococcus aureus effectively protects against Staphylococcal Lung infections,mainly via Th1 cell-mediated immunity[J].PLoS One,2015,10(9):e0136021.
[38]SALVEDA M L M,MEINDERTS S M,HAMSTRA H J,et al.Surface display of a borrelial lipoprotein on meningococcal outer membrane vesicles[J].Vaccine,2016,34(8):1025-1033.
[39]LEITNER D R,SABINE L,PHILIPP T,et al.A combined vaccine approach against Vibrio cholerae and ETEC based on outer membrane vesicles[J].Frontiers in Microbiology,2015,6:823.
[40]KIRSTEN K,MARIA A,DALEKE-SCHERMERHORN,et al.Salmonella outer membrane vesicles displaying high densities of pneumococcal antigen at the surface offer protection against colonization[J].Vaccine,2015,33(17):2022-2029.
[41]DALEKE-SCHERMERHORN M H,TRISTAN F,ZORAS,et al.Decoration of outer membrane vesicles with multiple antigens by using an autotransporter approach[J].Applied Environmental Microbiology,2014,80(18):5954-5965.
[42]Committee on Infectious Diseases.Recommendations for serogroup B meningococcal vaccine for persons 10 years and older[J].Pediatrics,2016,138(3):e20161890.
[43]ZHU H L,CHEN F,WU Y.Inflammatory response of macrophages induced by outer membrane vesicles of Pseudomonas aeruginosa via TLR4/NF-κB pathway[J].International Journal of Immunology,2020,43(3):257-262.
[44]朱宏亮,陈帆,吴豫.铜绿假单胞菌外膜囊泡经TLR4/NF-κB通路诱导巨噬细胞炎症反应[J].国际免疫学杂志,2020,43(3):257-262.
[45]ZARIRI A,BESKERS J,BAS V D W,et al.Meningococcal outer membrane vesicle composition-dependent activation of the innate immune response[J].Infect Immunity,2016,84(10):3024-3033.
[46]HANEBERG B,DALSEG R,OFTUNG F,et al.Towards a nasal vaccine against meningococcal disease,and prospects for its use as a mucosal adjuvant[J].Developments in Biological Standardization,1998,92:127-133.
[47]AGHASADEGHI M R,SALMANI A S,SADAT S M,et al.Application of outer membrane vesicle of Neisseria meningitidis serogroup B as a new adjuvant to induce strongly Th1-oriented responses against HIV-1[J].Current HIV Research,2011,9(8):630-635.
[48]NAGAPUTRA J C,ROLLIER C S,SADARANGANI M,et al.Neisseria meningitidis native outer membrane vesicles containing different lipopolysaccharide glycoforms as adjuvants for meningococcal and nonmeningococcal antigens[J].Clinical and Vaccine Immunology,2014,21(2):234-242.
[49]KOLLING G L,MATTHEWS K R.Export of virulence genes and shiga toxin by membrane vesicles of Escherichia coli O157:H7[J].Applied and Environmental Microbiology,1999,65(5):1843-1848.
[50]ALVES N J,TURNER K B,MEDINTZ I L,et al.Protecting enzymatic function through directed packaging into bacterial outer membrane vesicles[J]. Scientific Reports, 2016, 6(1): 24866.
[51] ARIGITA C, JISKOOT W, WESTDIJK J, et al. Stability of mono- and trivalent meningococcal outer membrane vesicle vaccines[J]. Vaccine, 2004, 22(5-6): 629-642.
[52] GERRITZEN M J H, MARTENS D E, WIJFFELS R H,et al. Bioengineering bacterial outer membrane vesicles as vaccine platform[J]. Biotechnology Advances, 2017, 35 (5): 565-574.
[53] LEO V D P, STORK M, PETER V D L. Outer membrane vesicles as platform vaccine technology[J]. Biotechnology Journal, 2015, 10(11): 1689-1706.
[54] RAPPAZZO C G, WATKINS H C, GUARINO C M, et al. Recombinant M2e outer membrane vesicle vaccines protect against lethal influenza A challenge in BALB/c mice[J]. Vaccine, 2016, 34(10): 1252-1258.
[55] ASAI A, RAZAVI S, TALEBI M, et al. Correction to: A review on anti-adhesion therapies of bacterial diseases [J]. Infection, 2019, 47(1): 25-26.
[56] DENIS K, LE BRIS M, LE GUENNEC L, et al. Targeting Type IV pili as an antivirulence strategy against invasive meningococcal disease[J]. Nature Microbiology, 2019, 4 (6): 972-984.
[57] SHARON N. Carbohydrates as future anti-adhesion drugs for infectious diseases[J]. Biochim Biophys Acta. 2006, 1760(4): 527-537.
[58] ZHANG Y, CHEN Y, LO C, et al. Inhibition of pathogen adhesion by bacterial outer membrane-coated nanoparticles[J]. Angewandte Chemie International Edition, 2019, 58(33): 11404-11408.
[59] BAUWENS A, KUNSMANN L, KARCH H, et al. Antibiotic-mediated modulations of outer membrane vesicles in enterohemorrhagic Escherichia coli O104: H4 and O157: H7[J]. Antimicrobial Agents and Chemotherapy, 2017, 61(9): e00937-17.
[60] XING X Y, WANG X C, HE W. Tumor immunotherapy and drug development progress[J]. Journal of China Pharmaceutical University, 2021, 52(1): 10-19.
[61] 邢续扬, 王孝春, 何伟. 肿瘤免疫治疗及其药物研发进 展[J]. 中国药科大学学报, 2021, 52(1): 10-19.
[62] SANMAMED M F, CHEN L. A paradigm shift in cancer immunotherapy: from enhancement to normalization[J]. Cell, 2018, 175(2): 313-326.
[63] LI M, ZHOU H, JIANG W, et al. Nanovaccines integrating endogenous antigens and pathogenic adjuvants elicit potent antitumor immunity[J]. Nano Today, 2020, 35: 101007.










