芽孢杆菌 B55 产羧甲基纤维素酶的培养优化研究论文
2024-04-30 11:47:50 来源: 作者:liyuan
摘要:芽孢杆菌来源的纤维素酶具有耐热耐碱等优良催化特性,故而受到了广泛关注。本研究利 用筛选的芽孢杆菌B55 发酵生产羧甲基纤维素酶,在确定碳源、氮源、金属盐、羧甲基纤维素添加 量、接种量等对菌株产酶影响的基础上,进行正交试验优化以确定最佳发酵培养工艺。研究结果表 明:最佳培养工艺的配方为 30 g/L 甘油、5 g/L 葡萄糖、3 g/L 大豆蛋白胨、16 g/L 酵母浸粉、4 g/L 羧 甲基纤维素、3 g/L 磷酸氢二钾,3 g/L 磷酸二氢钠,pH 7.0,在 4%(V/V)接种量、培养温度 32 ℃的
摘 要:芽孢杆菌来源的纤维素酶具有耐热耐碱等优良催化特性,故而受到了广泛关注。本研究利 用筛选的芽孢杆菌B55 发酵生产羧甲基纤维素酶,在确定碳源、氮源、金属盐、羧甲基纤维素添加 量、接种量等对菌株产酶影响的基础上,进行正交试验优化以确定最佳发酵培养工艺。研究结果表 明:最佳培养工艺的配方为 30 g/L 甘油、5 g/L 葡萄糖、3 g/L 大豆蛋白胨、16 g/L 酵母浸粉、4 g/L 羧 甲基纤维素、3 g/L 磷酸氢二钾,3 g/L 磷酸二氢钠,pH 7.0,在 4%(V/V)接种量、培养温度 32 ℃的条 件下,发酵 48 h 获得最大酶活力 401.34 U/mL,具备规模生产的应用潜力。
关键词:羧甲基纤维素酶;芽孢杆菌;培养优化;发酵生产
木质纤维素是世界上最丰富的可再生资源,占 全球生物总量的 80%以上,是自然界分布最广、含 量最多的一种多糖,纤维素酶可以将纤维素转化成 可利用性糖类,是开发利用木质纤维素的关键[1-2]。 纤维素酶是一类可以水解 β-1,4 葡萄糖苷键,使纤 维素分解为纤维二糖和葡萄糖的酶系总称,包括内 切葡萄糖苷酶(endoglucanase,EC 3.2.1.4,又称羧甲 基纤维素酶)、外切葡萄糖苷酶(cellobiohydrolase, EC 3.2.1.91,又称微晶纤维素酶)和 β-葡萄糖苷酶 (β-glucosidase,EC 3.2.1.21)[3 -4] 。羧甲基纤维素酶 (CMCase)是内切型纤维素酶,作用于纤维素的 β - 1,4 糖苷键上,其活力会直接影响纤维素的水解效 率[5]。
纤维素酶除了可用于木质纤维素降解,在酿造、 饲料、中药提取、纺织、造纸、洗涤等行业领域也得到 了广泛应用[6-8]。作为目前糖苷酶类中尚存在大量亟 待解决问题的一类酶,如何提高酶的活力并研发适 应催化条件的纤维素酶成为了当前的主要研究趋 势[9] 。随着亿万年的自然演化,众多产纤维素酶的细 菌、真菌和放线菌等被陆续发现[10-11]。作为芽孢杆菌 类细菌来源的纤维素酶拥有耐热、耐碱等优良催化特性,近年来其在饲料添加剂等领域的应用备受重 视[12-13] 。芽孢杆菌所产的纤维素酶以羧甲基纤维素 酶为主[14]。本文通过对分离自近海土壤中能降解羧 甲基纤维素的芽孢杆菌 B55 培养优化过程的研究, 挖掘其产 CMCase 的潜力,以期为后续的相关应用 性研究提供数据依据和理论支撑。
1 材料与方法
1.1 材料
分离筛选自山东烟台近海土壤的芽孢杆菌 (Bacillus sp.)B55,现保存于鲁东大学应用微生物研 究所。 羧甲基纤维素(CMC)购自生工生物工程(上 海)股份有限公司,其余所用试剂均为分析纯或生物 纯。
1.2 方法
1.2.1 菌种活化
试管斜面保藏的 Bacillus sp. B55 转接活化培 养基 ,在 30 ℃、200 r/min 的条件下培养至菌体浑 浊。活化培养基:10 g/L 蛋白胨,5 g/L 酵母粉,10 g/L 氯化钠,pH 6.5,121 ℃灭菌 15 min。
1.2.2 培养优化
将一定量的活化菌种接入发酵培养基,在 30 ℃、200 r/min 的条件下,确定碳源、氮源和金属盐、 CMC 添加量、接种量对菌种产 CMCase 的影响,发 酵培养 24 h 后测定CMCase 的活力。根据影响因素 的优化结果,正交试验确定菌株 B55 产 CMCase 的 最佳变量值,通过最佳培养工艺确定最佳产酶条件。
1.2.3 酶活和菌浓测定[15]
培养液经 10 000 r/min 离心 5 min 去菌体后获 得上清酶液,取 1 mL 适当稀释度的酶液,在其中添 加 1 mL1% CMC 底物溶液,45 ℃水浴保温反应 20 min 后,加入 3 mLDNS 试剂,沸水浴 5 min 显色并定 容至 25 mL 后,取 4 mL 反应样液以 8 000 r/min 离 心 5 min。取离心后的上清液,在 540 nm 处测定吸 光度值,根据葡萄糖标准曲线计算酶活力。以单位 体积(mL)、单位时间(min)水解羧甲基纤维素所产 生葡萄糖的 μg 数为酶活力单位。
发酵培养液加纯净水稀释至适当浓度,并以纯 水作为空白对照,在 600 nm 处测定吸光度,以 OD600 指示菌体浓度。
2 结果与讨论
2.1 碳源对菌株 B55 产 CMCase影响
采用发酵培养基:20 g/L 碳源,2 g/L CMC,5 g/L 酵母浸粉,10 g/L 大豆蛋白胨,3 g/L 磷酸氢二钾,3 g/L 磷酸二氢钠,pH 7.0。在 30 ℃、200 r/min 条件下 摇床培养 24 h,碳源对菌株产 CMCase 活性影响见 图 1。结果显示,以甘油为碳源时获得最大 CMCase 活性 146.45 U/mL,其次为葡萄糖(130.27 U/mL)。
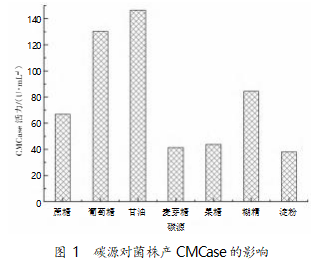
2.2 氮源对菌株 B55 产 CMCase 影响
采用发酵培养基:20 g/L 甘油,15 g/L 氮源,2 g/ L CMC,3 g/L 磷酸氢二钾,3 g/L 磷酸二氢钠,pH 7.0。在 30 ℃、200 r/min 的条件下摇床培养 24 h,氮 源对菌株产 CMCase 活性的影响见图 2。由图中结 果可知 ,最佳产酶氮源为大豆蛋白胨 ,产酶量为 153.24 U/mL;酵母粉、尿素、磷酸氢二铵为氮源时, CMCase 产量也相对较高。
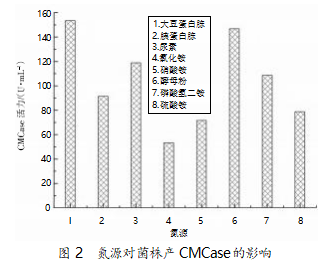
2.3 金属盐对菌株 B55 产 CMCase 影响
选取发酵培养基:20 g/L 甘油,15 g/L 大豆蛋白 胨,2 g/L CMC,3 g/L 磷酸氢二钾,3 g/L 磷酸二氢 钠,3 g/L 金属盐,pH 7.0。在 30 ℃、200 r/min 的条件 下摇床培养 24 h,金属盐对菌株产 CMCase 活性的 影响见图 3。由图 3 可以看出,额外再添加金属盐会 对菌株产 CMCase 的活力产生负影响;与对照组相 比,添加金属盐组的 CMCase 活力均得到了不同程 度的降低。
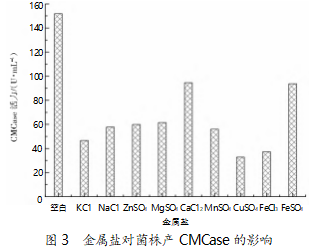
2.4 CMC 添加量对菌株 B55 产 CMCase 影响
纤维素酶属于水解酶,多为诱导酶,合适的诱导 物添加量可以显著提升纤维素酶的产量[16] 。选用发 酵培养基:20 g/L 甘油,15 g/L 大豆蛋白胨,3 g/L 磷 酸氢二钾,3 g/L 磷酸二氢钠,不同浓度的 CMC,pH 7.0。在 30 ℃、200 r/min 的条件下摇床培养 24 h,诱 导物 CMC 对菌株产 CMCase 活性的影响见图 4。由 图 4 可以看出,随着底物 CMC 添加量的增加,酶活 性逐渐增加,当诱导物添加至一定量时,即质量浓度 为 2~4 g/L 时,酶产量相对稳定,其中添加量为 4 g/L CMC 时可获得最大 CMCase 活力,为 166.69 U/mL。
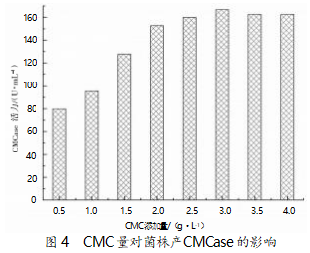
2.5 接种量对菌株 B55 产 CMCase影响
选取如下培养基组分:20 g/L 甘油,15 g/L 大豆 蛋白胨,3 g/L 磷酸氢二钾,3 g/L 磷酸二氢钠,4 g/L CMC,pH 7.0。装液量 100 mL/500 mL 瓶,每瓶接种 不同量的活化菌种,在 30 ℃、200 r/min 的条件下摇 床培养 24 h,确定接种量对菌株 B55 产 CMCase 的影响。由图 5 可以看出,菌株 B55 产 CMCase 的最佳 接种量是 4%(V/V),酶活力为 167.24 U/mL。

2.6 正交试验优化
根据对菌种进行单因素优化所得出的结论,选 取甘油、葡萄糖、大豆蛋白胨、酵母粉、CMC、接种量、 温度等 7 项变量进行 7 因素 2 水平的正交试验设 计,其因素和水平见表 1。
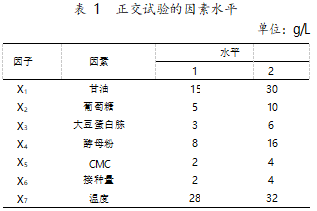
根据所列的 7 因素和 2 水平的条件,利用正交试验设计软件进行正交试验设计,结果见表 2。
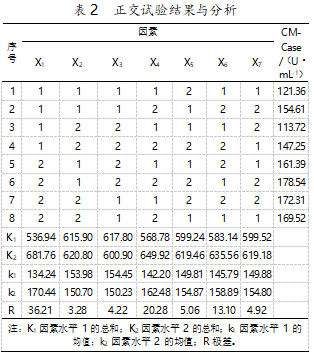
根据极差 R 值分析可知,在正交试验的 7 个因 素中,甘油对菌株 CMCase 产量的影响最大,其次是 酵母粉、接种量、培养温度、大豆蛋白胨和葡萄糖。通 过对 k1、k2 值的比较分析,确定 7 个因素的最佳变量 值分别为 30 g/L 甘油、5 g/L 葡萄糖、3 g/L 大豆蛋白胨、16 g/L 酵母浸粉、4 g/L CMC、4%(V/V)接种量和 培养温度 32 ℃。
2.7 发酵培养曲线
结合培养因素对菌株产酶的影响和正交试验优 化结果,确定 Bacillus sp. B55 发酵生产 CMCase 的 最佳培养组分为 30 g/L 甘油、5 g/L 葡萄糖、3 g/L 大 豆蛋白胨、16 g/L 酵母浸粉、4 g/L CMC、3 g/L 磷酸 氢二钾,3 g/L 磷酸二氢钠,pH 7.0;最佳发酵条件为 4%(V/V)接种量、培养温度 32 ℃、装液量 100 mL/ 500 mL。采用优化过的培养工艺,Bacillus sp.B55 发 酵生产羧甲基纤维素酶的培养曲线见图 6 ,在经短 暂停滞期后快速进入对数生长期,在 36 h 时菌体浓 度达到最大,为 45.32(OD600),随后进入静止期,菌 体浓度缓慢下降。
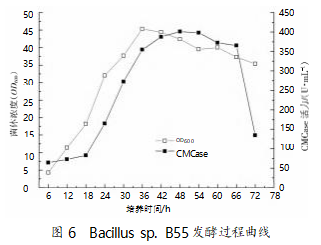
对 CMCase 而言,在菌体快速增殖阶段,酶表达 量会随菌体浓度增加而快速上升,当菌体生长进入 静止期后,酶活性仍呈增长趋势,在发酵 48 h 时获 得最大酶活性 401.34 U/mL。因此,Bacillus sp. B55 生产 CMCase 的过程为非生长偶联型(滞后合成 型),会受到分解代谢物的阻遏。发酵时间超过 66 h 后,菌体开始自溶,酶活性快速降低。
3 结语
芽孢杆菌属微生物具有较强的耐热性,所产纤 维素酶多为碱性纤维素酶,因此在饲料、洗涤、食品 等领域得到了广泛应用[17]。本研究首先优化确定了 Bacillus sp. B55 产 CMCase 的影响因素,并在此基 础上通过正交试验确定各变量因素的最佳变量值。 研究结果显示 ,使用优化的培养工艺发酵生产CMCase ,发酵 36 h 可获得最大菌体浓度 45.32 (OD600),48 h CMCase 活力为 401.34 U/mL。该研究 成果可为后续进行规模化制备与催化特性研究提供 良好的数据支撑。此外,本研究所用的产酶菌株为耐 热芽孢杆菌 ,属于潜在益生菌 ,可将 CMCase 和 Bacillus sp. B55 菌体一并作为饲用微生态制剂用于 饲料行业。
参 考 文 献
[1] BEHERA B C, SETHI B K, MISHRA R R, et al. Microbial cellulases Diversity & biotechnology with reference to mangrove environment: A review[J]. Journal of Genetic Engineering and Biotechnology, 2017, 15(1):197-210.
[2] BANSAL N, TEWARI R, SONI R, et al. Production of cellulases from Aspergillus niger NS-2 in solid state fermentation on agricultural and kitchen waste residues [J]. Waste Manage, 2012, 32: 1341-1346.
[3] INFANZÓN-RODR魱GUEZ M I, RAGAZZO-SÁNCHEZ J A, MORAL S, et al. Optimization of cellulase production by Aspergillus niger ITV 02 from sweet sorghum bagasse in submerged culture using a Box Behnken design[J]. Sugar Technology, 2020, 22: 266-273.
[4] SIQUEIRA J G W, RODRIGUES C, VANDENBERGHE L P S, et al. Current advances in on-site cellulase production and application on lignocellulosic biomass conversion to biofuels: A review[J]. Biomass and Bioenergy, 2020, 132: 105419.
[5] BEHERA B C, SETHI B K, MISHRA R R, et al. Microbial cellulases Diversity & biotechnology with reference to mangrove environment: A review[J]. Journal of Genetic Engineering and Biotechnology, 2017,15: 197-210.
[6] 程仕伟, 李坦坦, 梁会会, 等. 响应面优化金橙黄微杆菌 YT9 的发酵条件生产纤维素酶[J]. 中国酿造,2013, 32(4): 48-51.
[7] BAO L, HUANG Q, CHANG L, et al. Screening and characterization of a cellulase with endocellulase and exocellulase activity from yak rumen metagenome[J]. Journal of Molecular Catalysis B: Enzymatic, 2011,73: 104-110.
[8] WANG Y, WANG X, TANG R, et al. A novel thermostable cellulase from Fervidobacterium nodosum[J]. Journal of Molecular Catalysis B: Enzymatic, 2010, 66: 294-301.
[9] WANG Z, ONG H X, GENG A. Cellulase production and oil palm empty fruit bunch saccharification by a new isolate of Trichoderma koningii D-64[J]. Process Biochemistry, 2012, 47: 1564-1571.
[10] ZHANG Z, DONALDSON A A, MA X. Advancements and future directions in enzyme technology for biomass conversion[J]. Biotechnology Advances,2012, 30: 913-919.
[11] ZHU C, XU Z, SONG R. The endoglucanase from Bacillus subtilis BEC-1 bears halo-tolerant, acidophilic and dithiothreitol-stimulated enzyme activity[J]. World Journal of Microbiology and Biotechnology, 2011, 27: 2863-2871.
[12] 张璐璐, 卫旭彪, 斯大勇, 等. 产纤维素酶芽孢杆菌的筛选及鉴定[J]. 饲料工业, 2016, 37(18): 45-49.
[13] 马军, 王耀嵘, 侯萍, 等. 一株源于红树林根际土壤产 纤维素酶芽孢杆菌的鉴定及其酶学性质分析[J]. 海 洋与湖沼, 2019, 47(5): 997-1004.
[14] YADAV A, ALI A A M, INGAWALE M, et al. Enhanced co-production of pectinase, cellulase and xylanase enzymes from Bacillus subtilis ABDR01 upon ultrasonic irradiation[J]. Process Biochemistry, 2020, 92: 197-201.
[15] 程仕伟, 崔海洋, 黄田红, 等. 产纤维素酶枯草芽孢杆 菌 B29 的鉴定与培养条件研究[J]. 西华大学学报( 自 然科学版), 2013, 32(3): 94-104.
[16] SILVA J C R, SALGADO J C S, VICI A C, et al. A novel Trichoderma reesei mutant RP698 with enhanced cellulase production[J]. Brazilian Journal of Microbiology, 2020, 51: 537-545.
[17] HERO J S, PISA, J H, PEROTTI N I, Et al. Endoglucanase and xylanase production by Bacillus sp AR03 in co-culture[J]. Preparative Biochemistry & Biotechnology, 2017, 47(6): 589-596.










